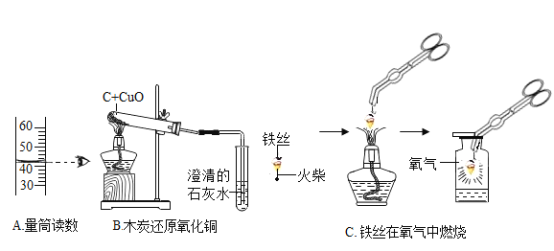
题目内容
【题目】Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。
实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | 温度/℃ | pH | 浓度/(mg·L-1) | |
H2O2 | Fe2+ | ||||
① | 为②③提供参照 | 25 | 3 | 204 | 16.8 |
② | 探究温度对降解反应速率的影响 | ________ | ________ | 204 | 16.8 |
③ | ________ | 25 | 10 | 204 | 16.8 |
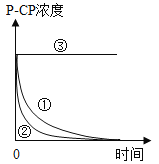
实验测得p-CP的浓度随时间变化的关系如图。
(2)实验发现,温度过高时,降解反应较难发生。请从Fenton法所用试剂的角度分析原因:__________。
(3)为测定不同时间内有机物降解的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:____________________。
【答案】40 3 探究溶液pH对降解反应速率的影响 温度过高时H2O2易分解 将所取样品调节pH至10(其他答案合理即可)
【解析】
(1)根据控制变量法的原则,实验②探究温度对降解反应速率的影响,所以其他条件相同,温度不同,温度为40℃,pH为3;实验③探究溶液pH对降解反应速率的影响,所以其他条件相同,pH不同,温度为25℃,pH为10;
(2)温度过高时H2O2易分解,不能生成活性成分,降解反应很难发生;
(3)根据实验③可知,污染物在温度为25℃,pH为10时,基本不降解,所以为了能让反应迅速停止,可以将所取样品调节pH至10。

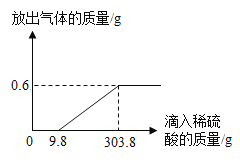
【题目】为测定某样品中锌的质量分数,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设锌的样品中杂质不与稀硫酸反应,且不溶于水),每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 10 | 10 | 10 | 10 | 10 |
剩余固体质量/g | 8.4 | 6.8 | 5.2 | 3.6 | 3.6 |
请认真分析表中的数据,回答下列问题:
(1)表示样品与稀硫酸恰好完全反应的是上表中第________次操作;
(2)计算样品中锌的质量分数; ____
(3)计算实验中所用稀硫酸的溶质质量分数。 ______