题目内容
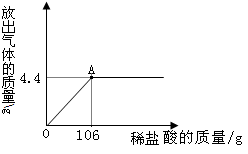
长时间使用的热水壶底部有一层水垢,主要成分是CaCO3。某校化学研究性学习小组同学通过实验想测定水垢中CaCO3的含量。他们取100g水垢,加入足量的稀盐酸,同时测量5分钟(min)内生成CO2质量,测量数据如下表:
| 时间/ min | 1 | 2 | 3 | 4 | 5 |
| 生成CO2的质量/g | 15 | 25 | 30 | 33 | 33 |
②请根据表格分析写出你发现的一条规律是 。
③该水垢中CaCO3的质量分数是多少?
①是②随着反应时间的增长化学反应速度逐渐降低;③75%
解析试题分析:依据表中数据4分钟生成二氧化碳33g,5分钟是也生成33g二氧化碳,说明在4 min后,水垢中的CaCO3反应完全,由时间差相等,买单生成气体的质量差逐渐减少,得出规律;然后根据化学方程式进行计算
解:①是;
②随着反应时间的增长化学反应速度逐渐降低;(其他合理答案也可以)(
③解:设水垢中CaCO3的质量为X,则有:
CaCO3 + 2HCl═ CaCl2 + H2O + CO2 ↑
100 44
X 33g
100 : 44 =" X" : 33g
X=75g
水垢中CaCO3的质量分数为:75g÷100g ×100% =" 75%"
答:该水垢中CaCO3的质量分数为75% 。
考点:反应推断、依据化学方程式的简单计算

如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去)。
(1)计算该实验最多可以生成多少克二氧化碳?(请根据化学方程式列式计算)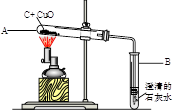
(2)实验前后分别称量了装置A和装置B的质量如表中所示。若数据Ⅰ准确,请回答:
a反应后A中固体的成分是_ 。
b数据Ⅱ存在的问题是_ ,可能的原因是 。
| | 反应前质量(g) | 反应后质量(g) | |
| Ⅰ | 装置A | 125.3 | 124.2 |
| Ⅱ | 装置B | 152 | 152.3 |
某同学为了测定实验室中氯酸钾样品的纯度,取2.5g该样品与0.5g二氧化锰混合.加热该混合物t1时间后(杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加热t2、t3、t4时间后剩余固体的质量,记录数据如下表:
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 2.12 | 2.08 | 2.04 | 2.04 |
(1)加热t3时间后氯酸钾是否已经完全反应? (填是或否).
(2)求完全反应后产生氧气的质量 .
(3)求该样品中氯酸钾的质量分数.