题目内容
工业上用煅烧石灰石(主要成分为CaCO3)制取生石灰,其生产流程图如下:
(1)某工厂用12t含碳酸钙为75%的石灰石,其中所含碳酸钙的质量是 t.
(2)上述石灰石理论上可以制得生石灰多少t?(写出计算过程)
9;8.04t
解析试题分析:(1)碳酸钙的质量=12t×75%=9t;
(2)设生成氧化钙的质量为x.则
CaCO3 CaO+CO2↑
CaO+CO2↑
100 56
9t x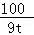 =
=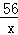 ,
,
解之得:x=5.04t
因为生成的生石灰中含有未参与反应的杂质,杂质的质量=12t×(1﹣75%)=3t
所以最终可以生产生石灰的质量=5.04t+3t=8.04t
答:可生产生石灰8.04t.
考点:含杂质物质的化学反应的有关计算.

练习册系列答案
相关题目
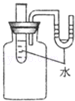
长期使用的水壶底部结有一层水垢,其主要成分是碳酸钙和氢氧化镁,为较准确测定水垢中氢氧化镁的含量,实验小组分别取三份同样的水垢样品各7.00g,利用如图所示装置连续进行三次实验,并将每次实验中装置B的质量变化记录于下表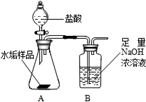
| | 第一次 | 第二次 | 第三次 | 平均值 |
| B装置增加的质量 | 2.17 | 2.22 | 2.21 | |
(1)第一次实验测得数据较低的原因是___________;
(2)平均每份水垢样品中碳酸钙的质量为___________克.
长时间使用的热水壶底部有一层水垢,主要成分是CaCO3。某校化学研究性学习小组同学通过实验想测定水垢中CaCO3的含量。他们取100g水垢,加入足量的稀盐酸,同时测量5分钟(min)内生成CO2质量,测量数据如下表:
| 时间/ min | 1 | 2 | 3 | 4 | 5 |
| 生成CO2的质量/g | 15 | 25 | 30 | 33 | 33 |
②请根据表格分析写出你发现的一条规律是 。
③该水垢中CaCO3的质量分数是多少?