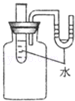
题目内容
如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去)。
(1)计算该实验最多可以生成多少克二氧化碳?(请根据化学方程式列式计算)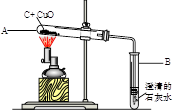
(2)实验前后分别称量了装置A和装置B的质量如表中所示。若数据Ⅰ准确,请回答:
a反应后A中固体的成分是_ 。
b数据Ⅱ存在的问题是_ ,可能的原因是 。
| | 反应前质量(g) | 反应后质量(g) | |
| Ⅰ | 装置A | 125.3 | 124.2 |
| Ⅱ | 装置B | 152 | 152.3 |
(1)2.2g;(2)a氧化铜和铜 b数据Ⅱ中反应后的质量偏小 澄清石灰水量不足,没有将生成的二氧化碳全部吸收
解析试题分析: 解;设生成二氧化碳的物质的量为x
C+2CuO 2Cu+CO2
2Cu+CO2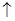
2 1
0.1 x
X="0.05" )
0.05mol ×44g/mol="2.2g"
②如完全反应质量应该减少2.2g,而实际减少了125.3g-124.2g=1.1g,剩余氧化铜,反应后A中固体的成分是氧化铜和铜 因为生成了二氧化碳1.1g, Ⅱ中只增加了0.3g,故数据Ⅱ中反应后的质量偏小,可能的原因是澄清石灰水量不足,没有将生成的二氧化碳全部吸收(合理给分)可能的原因是
考点:有关化学方程式的计算,及误差分析

练习册系列答案
相关题目
下图是某药厂生产补钙剂的商品标签图。
| XXX儿童咀嚼片(60片装) |
| [主要成分]:碳酸钙、维生素 [功效]:补钙 [规格]:2.5g/片、每片中含:碳酸钙≥25%、维生素D:100IU [食用方法]:嚼食、每日一片 |
请你根据以上标标签信息完成下列计算
(1)主要成分碳酸钙的相对分子质量为 ;每片药剂中至少含钙元素的质量为 克。
(2)小红同学为测定其碳酸钙的含量标注是否属实。她取出4片研碎后放入烧杯中,逐滴加入稀盐酸至不再放出气体为止。共用去稀盐酸40g。称量烧杯中剩余物的质量为47.8g(不含烧杯质量,假定钙片其他成分不与盐酸反应。)求:
① 生成二氧化碳的质量
② 通过计算判断每片钙片中碳酸钙的含量是否属实[CaCO3+2HCl=CaCl2+H2O+CO2↑]
长时间使用的热水壶底部有一层水垢,主要成分是CaCO3。某校化学研究性学习小组同学通过实验想测定水垢中CaCO3的含量。他们取100g水垢,加入足量的稀盐酸,同时测量5分钟(min)内生成CO2质量,测量数据如下表:
| 时间/ min | 1 | 2 | 3 | 4 | 5 |
| 生成CO2的质量/g | 15 | 25 | 30 | 33 | 33 |
②请根据表格分析写出你发现的一条规律是 。
③该水垢中CaCO3的质量分数是多少?
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(1)不法分子常用黄铜制成金光闪闪的“假元宝”蒙骗人们.下列鉴别方法中错误的是 。
| A.看颜色 | B.灼烧 | C.加硝酸银溶液 | D.加盐酸 |
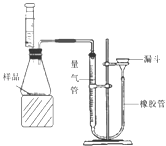
①检查装置气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差 ,说明气密性良好。
②正确读取量气管内液面的初始、最终读数前都需进行的操作是 。③该小组进行了三次实验,所得相关的实验数据处理如下:
| | 合金的质量/g | 稀硫酸的体积/mL | 生成氢气的质量/g |
| 第1次 | 2 | 15 | 0.04 |
| 第2次 | 2 | 20 | 0.04 |
| 第3次 | 4 | 15 | 0.04 |
b、分析上表数据,第 次实验,合金中的锌与稀硫酸恰好完全反应,稀硫酸的溶质质量分数为 (结果保留到0.1%)。(实验温度下,ρ(H2SO4)=1.08g/cm3)
 Na2SO4+2NH3↑+2H2O,
Na2SO4+2NH3↑+2H2O,