题目内容
将Na2SO4和NaOH的混合物10g投入到200g溶质质量分数为4.9%的H2SO4溶液中恰好完全反应.请计算:
(1)10g混合物中NaOH的质量;
(2)最后所得溶液中溶质的质量.
(1)10g混合物中NaOH的质量为8g;(2)最后所得溶液中溶质的质量为16.2g.
解析试题分析:200g溶质质量分数为4.9%的H2SO4溶液中溶质的质量为200g×4.9%=9.8g.
设混合物中NaOH的质量为x,生成硫酸钠的质量为y,
2NaOH+H2SO4═Na2SO4+2H20
80 98 142
x 9.8g y
(1)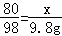 x=8g
x=8g
(2)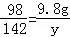 y=14.2g
y=14.2g
最后所得溶液中溶质为硫酸钠,其质量为:14.2g+(10g﹣8g)=16.2g.
答:(1)10g混合物中NaOH的质量为8g;(2)最后所得溶液中溶质的质量为16.2g.
考点:根据化学反应方程式的计算.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
长时间使用的热水壶底部有一层水垢,主要成分是CaCO3。某校化学研究性学习小组同学通过实验想测定水垢中CaCO3的含量。他们取100g水垢,加入足量的稀盐酸,同时测量5分钟(min)内生成CO2质量,测量数据如下表:
| 时间/ min | 1 | 2 | 3 | 4 | 5 |
| 生成CO2的质量/g | 15 | 25 | 30 | 33 | 33 |
②请根据表格分析写出你发现的一条规律是 。
③该水垢中CaCO3的质量分数是多少?
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(1)不法分子常用黄铜制成金光闪闪的“假元宝”蒙骗人们.下列鉴别方法中错误的是 。
| A.看颜色 | B.灼烧 | C.加硝酸银溶液 | D.加盐酸 |
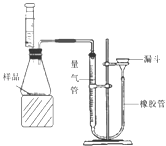
①检查装置气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差 ,说明气密性良好。
②正确读取量气管内液面的初始、最终读数前都需进行的操作是 。③该小组进行了三次实验,所得相关的实验数据处理如下:
| | 合金的质量/g | 稀硫酸的体积/mL | 生成氢气的质量/g |
| 第1次 | 2 | 15 | 0.04 |
| 第2次 | 2 | 20 | 0.04 |
| 第3次 | 4 | 15 | 0.04 |
b、分析上表数据,第 次实验,合金中的锌与稀硫酸恰好完全反应,稀硫酸的溶质质量分数为 (结果保留到0.1%)。(实验温度下,ρ(H2SO4)=1.08g/cm3)

 2CuSO4+2H2O.若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数.
2CuSO4+2H2O.若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数. O2↑+2H2O.请计算:
O2↑+2H2O.请计算: