题目内容
【题目】碳酸镁水合物是制备镁产品的中间体.
(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)获取MgCO33H2O的方法如图1:
(1)沉淀过程的化学方程式为:MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2____.
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为___(填字母).
a 向卤水中滴加NaOH溶液,同时通入CO2
b 向NaOH溶液中滴加卤水,同时通入CO2
c 向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d 向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
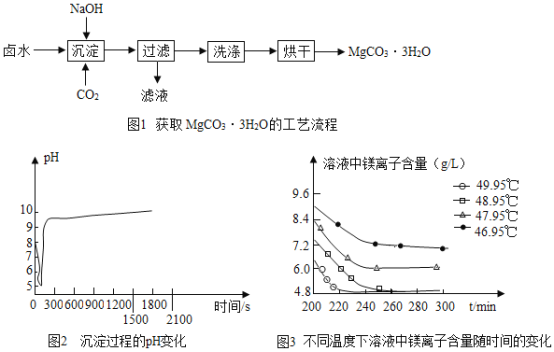
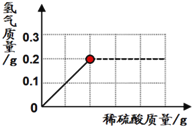
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如下表所示.则沉淀过程选择的温度为____,理由是_______。
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
(4)(测定MgCO33H2O的纯度)利用下图进行实验,以确定MgCO33H2O的纯度.
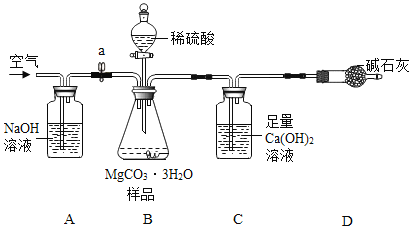
依据实验过程回答下列问题:
(5)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有____。
(6)C中化学方程式为___;A中NaOH作用为___;D中碱石灰作用为____.
(7)下列各项措施中,不能提高测定准确度的是___(填标号).
a 在加入硫酸之前,应排净装置内的CO2气体 b 为了缩短实验时间,快速滴加硫酸
c 在A~B之间增添盛有浓硫酸的洗气装置 d 在C装置左侧导管末端增添多孔球泡
(8)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g.请计算样品中MgCO33H2O的纯度___(写出计算过程).
(9)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有____.
(10)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则产品中镁元素的质量分数__(填“偏大”“不变”或“偏小”).
【答案】NaCl c 48.95℃ 此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀 把生成的二氧化碳全部排入C中,使之完全被氢氧化钙溶液吸收,否则装置内剩余的二氧化碳不被吸收,导致测定结果偏小 CO2+ Ca(OH)2 =CaCO3↓+ H2O 吸收空气中的二氧化碳 防止空气中的二氧化碳进入C中,干扰实验,使测定结果偏大 bc 92% 碳酸钡的相对分子质量比碳酸钙的大,等质量的MgCO33H2O生成的碳酸钡质量远大于碳酸钙,实验时相对误差小 偏大
【解析】
(1)化学反应前后各种原子个数相等,故反应的化学方程式为:MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2NaCl。
(2)根据图2可知,沉淀过程的pH值随时间的变化是先变小后变大,然后保持在9~10之间,而溶液起始的pH值在7~8之间,所以沉淀过程的操作为向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2,故选c。
(3)沉淀过程选择的温度是48.95℃,因为此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
(5)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还能把生成的二氧化碳全部排入C中,使之完全被氢氧化钙溶液吸收,否则装置内剩余的二氧化碳不被吸收,导致测定结果偏小。
(6)石灰水中的溶质是氢氧化钙,与二氧化碳反应生成碳酸钙沉淀和水,故C中化学方程式为:CO2+ Ca(OH)2=CaCO3↓+ H2O;A中NaOH作用为吸收空气中的二氧化碳;D中碱石灰作用为防止空气中的二氧化碳进入C中,干扰实验,使测定结果偏大。
(7)快速滴加硫酸,使生成的二氧化碳的速率太快,不能被充分吸收;在A~B之间增添盛有浓硫酸的洗气装置不能提高测定准确度,因为氢氧化钙不吸收水,故选bc。
(8)MgCO33H2O+H2SO4=MgSO4+4H2O+CO2↑ ,CO2+ Ca(OH)2=CaCO3↓+ H2O,可得关系式为:MgCO33H2O~CO2~CaCO3,设样品中MgCO33H2O的质量为x,
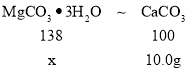
![]() ,解得x=13.8g
,解得x=13.8g
样品中MgCO33H2O的纯度为:![]() =92%
=92%
(9)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有碳酸钡的相对分子质量比碳酸钙的大,等质量的MgCO33H2O生成的碳酸钡质量远大于碳酸钙,实验时相对误差小。
(10)化合物中某元素的质量分数=![]() ,若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则产品中镁元素的质量分数偏大,因为MgCO33H2O中镁元素的质量分数为:
,若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则产品中镁元素的质量分数偏大,因为MgCO33H2O中镁元素的质量分数为:![]() ,而Mg5(OH)2(CO3)44H2O中镁元素的质量分数为:
,而Mg5(OH)2(CO3)44H2O中镁元素的质量分数为:![]() ,同质量的Mg5(OH)2(CO3)44H2O比MgCO33H2O生成碳酸钙沉淀多,所以计算的纯度偏大。
,同质量的Mg5(OH)2(CO3)44H2O比MgCO33H2O生成碳酸钙沉淀多,所以计算的纯度偏大。

【题目】除去下列各物质中的少量杂质,所选用的试剂、方法都能达到目的的是( )
选项 | 物质 | 杂质(少量) | 操作方法 |
A |
|
| 将混合气体通过灼热的碳粉 |
B |
|
| 加入适量氢氧化钙溶液,过滤 |
C | 铁粉 |
| 加入适量的稀盐酸,过滤 |
D |
|
| 加入适量 |
A.AB.BC.CD.D
【题目】如图所示,将气体X和气体Y同时通入液体Z,最终一定能看到液体变浑浊的是( )
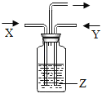
序号 | 气体X | 气体Y | 液体Z |
A | H2 | N2 | 水 |
B | HCl | CO2 | 石灰水 |
C | CO2 | O2 | 氯化钙溶液 |
D | CO2 | CO | 足量石灰水 |
A.AB.BC.CD.D