题目内容
【题目】水是宝贵的自然资源,请根据下图回答问题:
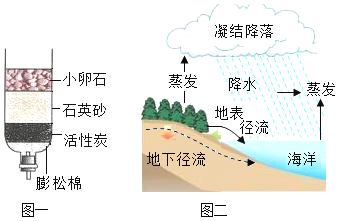
(1)图一是简易净水装置,其中小卵石和石英砂的作用是__________.
(2)图二是自然界水循环示意图,水蒸发过程中不发生变化的是__________(填字母).
A 分子质量 B 分子大小 C 分子间隙
(3)ClO2是一种高效、安全的自来水消毒剂,用化学用语表示该物质中氯元素的化合价________.
(4)同学们用蒸馏的方法得到蒸馏水,用于配置100g溶质质量分数为6.5%的氯化钠溶液,经测定其质量分数偏大,其可能的原因是_________(填字母).
A 氯化钠中有其它可溶性杂质 B 用量筒量取水时,俯视读数
C 砝码生锈 D 蒸发结晶时得到的氯化钠固体不干燥
【答案】过滤 AB +4 BC
【解析】
(1)图一是简易净水装置,其中小卵石和石英砂的作用是过滤,通过过滤除去颗粒较大的难溶于水的固体物质。
(2)自然界水循环,水蒸发过程中分子质量、分子大小不发生变化,是分子间隔发生改变,故选A、B。
(3)化合物中各元素化合价的代数和为零,ClO2中氧元素的化合价为-2,故氯元素的化合价+4。
(4)配置100g溶质质量分数为6.5%的氯化钠溶液,经测定其质量分数偏大,其可能的原因是溶质偏多或溶剂偏少。
A 氯化钠中有其它可溶性杂质,使得配制的氯化钠溶液中溶质质量偏小,此选项不符合题意;B 用量筒量取水时,俯视读数,量取水的体积偏少,使得配制的氯化钠溶液中溶质质量偏大,此选项符合题意;C 砝码生锈,砝码的质量偏大,称量的氯化钠的质量偏多,使得配制的氯化钠溶液中溶质质量偏大,此选项符合题意;D 蒸发结晶时得到的氯化钠固体不干燥,则氯化钠实际质量偏小,使得配制的氯化钠溶液中溶质质量偏小,此选项不符合题意。故选BC。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】碳酸镁水合物是制备镁产品的中间体.
(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)获取MgCO33H2O的方法如图1:
(1)沉淀过程的化学方程式为:MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2____.
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为___(填字母).
a 向卤水中滴加NaOH溶液,同时通入CO2
b 向NaOH溶液中滴加卤水,同时通入CO2
c 向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d 向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
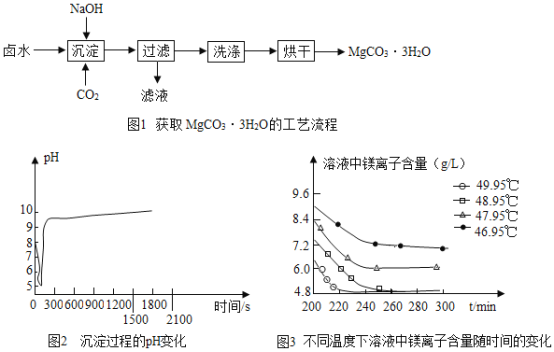
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如下表所示.则沉淀过程选择的温度为____,理由是_______。
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
(4)(测定MgCO33H2O的纯度)利用下图进行实验,以确定MgCO33H2O的纯度.
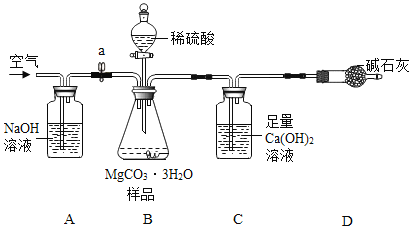
依据实验过程回答下列问题:
(5)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有____。
(6)C中化学方程式为___;A中NaOH作用为___;D中碱石灰作用为____.
(7)下列各项措施中,不能提高测定准确度的是___(填标号).
a 在加入硫酸之前,应排净装置内的CO2气体 b 为了缩短实验时间,快速滴加硫酸
c 在A~B之间增添盛有浓硫酸的洗气装置 d 在C装置左侧导管末端增添多孔球泡
(8)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g.请计算样品中MgCO33H2O的纯度___(写出计算过程).
(9)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有____.
(10)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则产品中镁元素的质量分数__(填“偏大”“不变”或“偏小”).
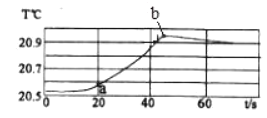
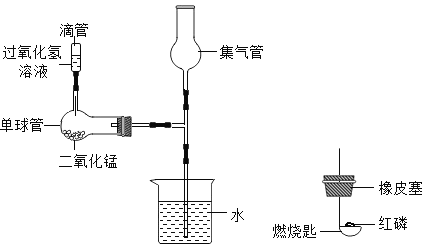
【题目】化学小组同学在加热二氧化锰样品时,发现有气泡产生(如图一所示),于是他们对这个异常现象进行了探究。
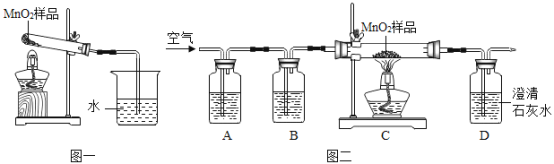
(1)对气体成分的探究:加热二氧化锰样品,将产生的气体通入澄清的石灰水,发现石灰水变浑浊,加点部分反应的化学方程式是_____________ ,由此可知:产生的气体是二氧化碳。
(2)对气体来源的探究:
(假设1)甲同学认为:该气体来自于试管中的空气,请你设计实验证明该假设不成立
实验步骤 | 实验现象 | 结论 |
试管中不放二氧化锰(或空试管),按图一装置进行加热,将气体通入澄清石灰水中 | ___________ | 假设不成立 |
(假设2)乙同学认为:二氧化锰样品中可能混有炭粉,炭粉发生反应生成了该气体。
(实验设计)他设计了如图二所示的实验进行研究,其中A装置中盛放氢氧化钠溶液,用于除去空气中的二氧化碳气体,B装置的作用是检验A中是否完全除尽二氧化碳气体,则B中应盛放的试剂是_____________,实验中观察到B处无明显变化而D处澄清石灰水变浑浊。
他又用氮气代替空气(氮气不参与该实验中的任何反应),重复上述实验,发现B处无明显变化且D处澄清的石灰水不变浑浊。
(结论)通过乙同学的实验证明,二氧化锰中混有炭粉,炭粉与空气中的____________反应产生了二氧化碳气体。
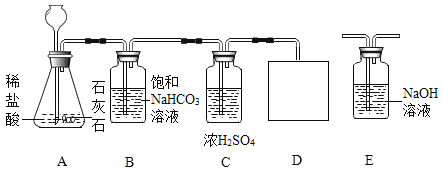
【题目】小亮同学对课本中C和CuO反应的产物进行了进一步的探究。以下是他进行实验的部分流程(装置气密性良好):
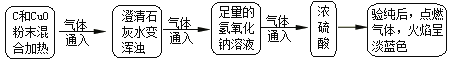
(1)通过以上实验,可知产物中有______气体。
(2)取出反应后的固体,观察呈红色。
(查阅资料)
①C也能将CuO还原为红色固体Cu2O(氧化亚铜)
②Cu2O + H2SO4(稀) = Cu + CuSO4 + H2O
(猜 想)(a)红色固体只是Cu
(b)____________。
(c)红色固体是Cu和Cu2O的混合物
(实验探究)
实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
取7.2g红色固体,置于烧杯中,向其中加入足量稀硫酸,充分搅拌,静置。 | 若无现象。 | 证明红色固体____________。 |
若____________ | 证明红色固体肯定含有______,可能含有_______。 | |
取上述反应液过滤、洗涤、干燥和称量,得固体6.8g 。 | 确认红色固体是_______。 |