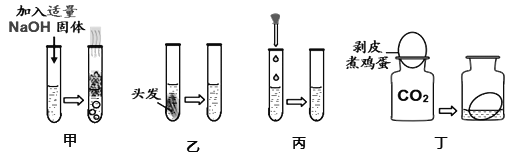
题目内容
【题目】如图所示,将气体X和气体Y同时通入液体Z,最终一定能看到液体变浑浊的是( )
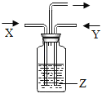
序号 | 气体X | 气体Y | 液体Z |
A | H2 | N2 | 水 |
B | HCl | CO2 | 石灰水 |
C | CO2 | O2 | 氯化钙溶液 |
D | CO2 | CO | 足量石灰水 |
A.AB.BC.CD.D
【答案】D
【解析】
A.氢气、氮气都不与水反应,不会出现浑浊现象,此选项不符合题意;
B. 氯化氢气体溶于水形成盐酸,二氧化碳虽然能使澄清石灰水变浑浊,但生成的碳酸钙沉淀能与形成的盐酸反应,当向澄清石灰水通入氯化氢气体、二氧化碳气体时,不一定会出现沉淀,此选项不符合题意;
C. 二氧化碳、氧气都不与氯化钙溶液反应产生沉淀,此选项不符合题意;
D. 二氧化碳能使澄清石灰水变浑浊,一氧化碳不与澄清石灰水反应,当向足量澄清石灰水中通入二氧化碳、一氧化碳时,会出现浑浊现象,此选项符合题意。
故选D。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】碳酸镁水合物是制备镁产品的中间体.
(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)获取MgCO33H2O的方法如图1:
(1)沉淀过程的化学方程式为:MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2____.
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为___(填字母).
a 向卤水中滴加NaOH溶液,同时通入CO2
b 向NaOH溶液中滴加卤水,同时通入CO2
c 向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d 向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
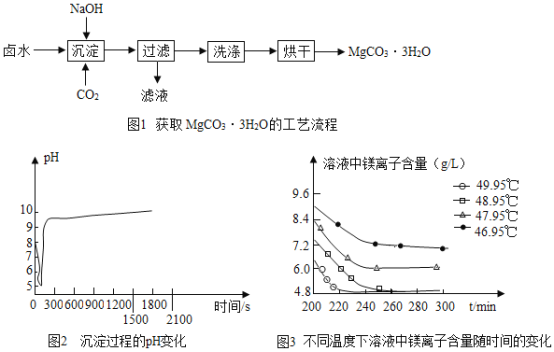
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如下表所示.则沉淀过程选择的温度为____,理由是_______。
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
(4)(测定MgCO33H2O的纯度)利用下图进行实验,以确定MgCO33H2O的纯度.
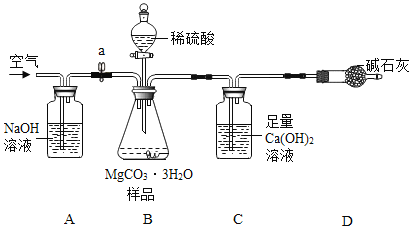
依据实验过程回答下列问题:
(5)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有____。
(6)C中化学方程式为___;A中NaOH作用为___;D中碱石灰作用为____.
(7)下列各项措施中,不能提高测定准确度的是___(填标号).
a 在加入硫酸之前,应排净装置内的CO2气体 b 为了缩短实验时间,快速滴加硫酸
c 在A~B之间增添盛有浓硫酸的洗气装置 d 在C装置左侧导管末端增添多孔球泡
(8)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g.请计算样品中MgCO33H2O的纯度___(写出计算过程).
(9)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有____.
(10)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则产品中镁元素的质量分数__(填“偏大”“不变”或“偏小”).
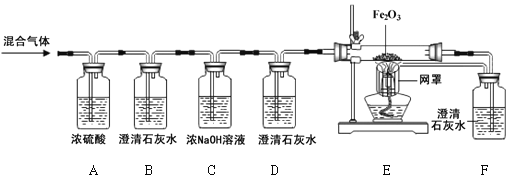
【题目】小亮同学对课本中C和CuO反应的产物进行了进一步的探究。以下是他进行实验的部分流程(装置气密性良好):
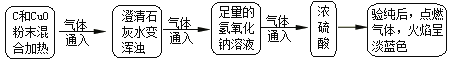
(1)通过以上实验,可知产物中有______气体。
(2)取出反应后的固体,观察呈红色。
(查阅资料)
①C也能将CuO还原为红色固体Cu2O(氧化亚铜)
②Cu2O + H2SO4(稀) = Cu + CuSO4 + H2O
(猜 想)(a)红色固体只是Cu
(b)____________。
(c)红色固体是Cu和Cu2O的混合物
(实验探究)
实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
取7.2g红色固体,置于烧杯中,向其中加入足量稀硫酸,充分搅拌,静置。 | 若无现象。 | 证明红色固体____________。 |
若____________ | 证明红色固体肯定含有______,可能含有_______。 | |
取上述反应液过滤、洗涤、干燥和称量,得固体6.8g 。 | 确认红色固体是_______。 |