题目内容
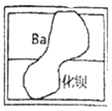
【题目】在学习盐的性质时,老师从实验室带来一瓶标签破损的溶液M![]() 如图
如图![]() 。
。
探究一:溶液M的溶质是什么?
(猜想与假设)
![]() 同学们认为溶液M的溶质可能是
同学们认为溶液M的溶质可能是![]() 或______
或______![]() 写化学式
写化学式![]()
(实验探究)同学们进行了如下探究:
实验操作 | 实验现象 | 实验结论 |
取溶液M于试管中,滴加无色酚酞溶液 | ______ | 溶液M的溶质不是 |
探究二:老师取一定量溶液M与碳酸钠溶液混合,有白色沉淀产生,过滤后得到澄清滤液,滤液中的溶质成分是什么?
(猜想与假设)甲、乙、丙三位同学对溶质的成分做出如下猜想:
甲同学的猜想:NaCl、![]()
乙同学的猜想:NaCl、![]()
丙同学的猜想:NaCl
(分析与讨论)![]() 同学们一致认为同学的猜想不正确,理由是______。
同学们一致认为同学的猜想不正确,理由是______。
(实验验证)甲同学为了证明自己的猜想,进行了如下实验:
实验操作 | 实验现象 | 实验结论 | 分析判断 |
取样于试管中,加入硝酸银溶液 | 有白色沉淀产生 | 自己的猜想正确 | 该实验结论 ______ |
(总结与交流)![]() 甲同学加入硝酸银溶液后,溶液中一定含有的离子是______
甲同学加入硝酸银溶液后,溶液中一定含有的离子是______![]() 填离子符号
填离子符号![]() 。同学们通过合作探究,最终确定了溶质的成分。
。同学们通过合作探究,最终确定了溶质的成分。
(反思与收获)![]() 由上述探究可知,若想证明反应所得溶液溶质成分的某种猜想是否成立,一般思路是:证明______。思路明确后,再选取合适的试剂,最终才能得出实验结论。
由上述探究可知,若想证明反应所得溶液溶质成分的某种猜想是否成立,一般思路是:证明______。思路明确后,再选取合适的试剂,最终才能得出实验结论。
【答案】![]() 溶液不变色 碳酸钡不溶于水 不正确
溶液不变色 碳酸钡不溶于水 不正确 ![]() 和NO3- 可溶性反应物是否存在
和NO3- 可溶性反应物是否存在
【解析】
探究一
提出猜想:由标签可知,溶液为钡的化合物溶液,可能是氢氧化钡或氯化钡(BaCl2);
实验探究:由于氢氧化钡溶液显碱性,氯化钡溶液显中性。因此取少量M溶液于试管中,向其中滴加酚酞试液,酚酞试液会变成红色;若结论是溶液M的溶质不是Ba(OH)2,则溶液不变色;
探究二
提出猜想:由于碳酸钠与氢氧化钡反应生成了碳酸钡沉淀和氢氧化钠,由于反应的量不同,所以过滤后澄清滤液中会有的溶质可能是NaOH和Na2CO3或NaOH和Ba(OH)2或NaOH;由于碳酸钡不溶于水,所以溶质不可能是碳酸钡,所以乙同学猜想错误;
实验验证:由于溶液中氯化钠、碳酸钠都能与加入的硝酸银反应产生白色沉淀,所以他的实验结论不正确;
总结与交流:
氯化钠、碳酸钠都能与加入的硝酸银反应产生白色沉淀和硝酸钠,甲同学加入硝酸银溶液后,溶液中一定含有的离子是![]() 和NO3-;
和NO3-;
反思与收获:由上述探究可知,若想证明反应所得溶液溶质成分的某种猜想是否成立,一般思路是:证明可溶性反应物是否存在。

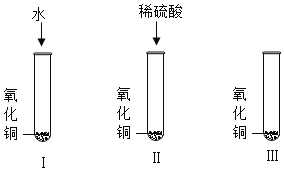
【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。

A | B |
(1)实验1中反应的化学方程式是_____。 (2)实验2中,加热液体时可观察到的现象是_____。 | (1)实验1的现象:剧烈燃烧,_____,放热,生成黑色固体。 (2)实验2中,石蕊溶液变红的原因是_____(用化学方程式表示)。 |