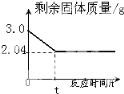题目内容
【题目】工业上生产电石![]() 并制备重要工业原料乙炔
并制备重要工业原料乙炔![]() 流程如下:
流程如下:

资料:![]() .碳酸钙高温分解可得两种氧化物。
.碳酸钙高温分解可得两种氧化物。
![]() .乙炔的相对分子质量是26,一个乙炔分子有四个原子构成。
.乙炔的相对分子质量是26,一个乙炔分子有四个原子构成。
![]() .B、C组成的元素相同,C有毒。
.B、C组成的元素相同,C有毒。
(1)写出A、B、C的化学式:A______B______C______。
(2)反应①化学方程式为______。
(3)将一定量的乙炔![]() 完全燃烧,生成
完全燃烧,生成![]() 水和
水和![]() 二氧化碳,则乙炔的化学式为______。
二氧化碳,则乙炔的化学式为______。
(4)若向D的澄清溶液中通入二氧化碳,有白色浑浊现象,则反应②的化学方程式为______。
【答案】CaO CO2 CO CaO+3C![]() CO↑+CaC2 C2H2 Ca(OH)2+CO2=CaCO3↓+H2O
CO↑+CaC2 C2H2 Ca(OH)2+CO2=CaCO3↓+H2O
【解析】
碳酸钙高温分解为固体氧化钙和气体二氧化碳,B是CO2,B、C组成的元素相同,C有毒,所以C为CO,根据化学反应前后元素的种类不变,碳化钙和水反应生成乙炔和氢氧化钙。
(1)化学式:A是 CaO,B是 CO2,C 是CO。
(2)根据题给信息,反应①的化学方程式为:CaO+3C![]() CO↑+CaC2。
CO↑+CaC2。
(3)将定量的乙炔(CxHy)完全燃烧,生成1.8g水和8.8g二氧化碳,则碳原子和氢原子的个数比为(![]() ×2):
×2):![]() =1:1,由于乙炔的相对分子质量是26,所以乙炔的化学式为 C2H2。
=1:1,由于乙炔的相对分子质量是26,所以乙炔的化学式为 C2H2。
(4)若向D的澄清溶液中通入二氧化碳,有白色浑浊现象,则是氢氧化钙和二氧化碳反应生成碳酸钙和水,对应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O。

【题目】在学习盐的性质时,老师从实验室带来一瓶标签破损的溶液M![]() 如图
如图![]() 。
。
探究一:溶液M的溶质是什么?
(猜想与假设)
![]() 同学们认为溶液M的溶质可能是
同学们认为溶液M的溶质可能是![]() 或______
或______![]() 写化学式
写化学式![]()
(实验探究)同学们进行了如下探究:
实验操作 | 实验现象 | 实验结论 |
取溶液M于试管中,滴加无色酚酞溶液 | ______ | 溶液M的溶质不是 |
探究二:老师取一定量溶液M与碳酸钠溶液混合,有白色沉淀产生,过滤后得到澄清滤液,滤液中的溶质成分是什么?
(猜想与假设)甲、乙、丙三位同学对溶质的成分做出如下猜想:
甲同学的猜想:NaCl、![]()
乙同学的猜想:NaCl、![]()
丙同学的猜想:NaCl
(分析与讨论)![]() 同学们一致认为同学的猜想不正确,理由是______。
同学们一致认为同学的猜想不正确,理由是______。
(实验验证)甲同学为了证明自己的猜想,进行了如下实验:
实验操作 | 实验现象 | 实验结论 | 分析判断 |
取样于试管中,加入硝酸银溶液 | 有白色沉淀产生 | 自己的猜想正确 | 该实验结论 ______ |
(总结与交流)![]() 甲同学加入硝酸银溶液后,溶液中一定含有的离子是______
甲同学加入硝酸银溶液后,溶液中一定含有的离子是______![]() 填离子符号
填离子符号![]() 。同学们通过合作探究,最终确定了溶质的成分。
。同学们通过合作探究,最终确定了溶质的成分。
(反思与收获)![]() 由上述探究可知,若想证明反应所得溶液溶质成分的某种猜想是否成立,一般思路是:证明______。思路明确后,再选取合适的试剂,最终才能得出实验结论。
由上述探究可知,若想证明反应所得溶液溶质成分的某种猜想是否成立,一般思路是:证明______。思路明确后,再选取合适的试剂,最终才能得出实验结论。