题目内容
【题目】现有含杂质的氯化镁样品10g (杂质不溶于水,也不参加反应),向其中加入一定量的氢氧化钠溶液恰好完全反应,过滤,得到117g质量分数为10%的溶液.求:
(1)样品中氯化镁的质量;
(2)所加入氢氧化钠溶液的质量分数(计算结果精确到0.1%)
【答案】(1)9.5g (2)7.1%
【解析】
氯化镁和氢氧化钠恰好反应生成氢氧化镁沉淀和氯化钠,所得滤液是氯化钠溶液,10%的溶液117g 中溶质氯化钠的质量是:117g×10%=11.7g,由方程式算出氯化镁、氢氧化钠的质量,根据质量守恒定律求解氢氧化钠溶液的质量,进而求得氢氧化钠溶液的质量分数。
解:设样品中氯化镁的质量为x,加入氢氧化钠溶液中溶质的质量为y,生成氢氧化镁的质量为z,

![]()
![]()
![]()
解得:x=9.5g,y=8.0g,z=5.8g
根据质量守恒定律,加入氢氧化钠溶液的质量=117g+5.8g-9.5g=113.3g
答:(1)样品中氯化镁的质量为9.5g;
(2)所加入氢氧化钠溶液的质量分数为:![]()

练习册系列答案
相关题目
【题目】请从A~D中任选三个作答,若均作答,按前三个计分。
实验目的 | 实验 | 回答问题 |
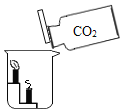
A 验证二氧化碳的密度比空气大 |
| 该实验除了验证CO2的密度比空气大之外,还能说明CO2 具有__________性质。 |
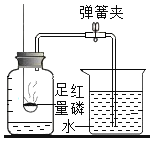
B 探究空气 中氧气含量 |
| 红磷燃烧的作用是 ______。 |
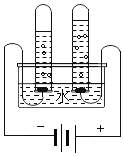
C 证明水的组成 |
| 该 反应的化学方程式 _____ |
D 检验NaCl中混有Na2CO3 |
| ①加入少量样品;②加入适量水至全部溶解;③加入____有气泡产生。 |