题目内容
【题目】硅胶是生活中常用的干燥剂,其生产过程如下图:
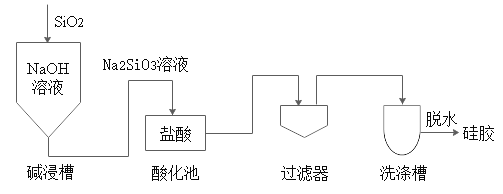
已知:H2SiO3难溶于水。
(1)硅酸钠(Na2SiO3)中硅元素的化合价为_____。
(2)酸化池中发生复分解反应的化学方程式为_____。
(3)上述流程中,洗涤槽的作用是_____。
【答案】+4 Na2SiO3+2HCl=2NaCl+H2SiO3↓ 洗去H2SiO3沉淀表面残留的滤液
【解析】
(1)解:设硅酸钠(Na2SiO3)中硅元素的化合价为x,则(+1)×2+x+(-2)×3=0,x=+4;
(2)酸化池中硅酸钠与稀盐酸发生反应产生氯化钠和硅酸沉淀的化学方程式为Na2SiO3+2HCl=2NaCl+H2SiO3↓。
(3)上述流程中,洗涤槽的作用是:洗去H2SiO3沉淀表面残留的滤液,得到纯净的硅酸产品。

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
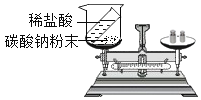
【题目】(1)某同学用市售浓盐酸(溶质质量分数为37%,密度为1.18gmL-1)配制800g溶质质量分数为10%的稀盐酸。通过计算可知需要浓盐酸 mL,水(密度lgmL-1) mL(上述两空答案都精确到0.1mL)
(2) 长期使用的热水锅炉会产生水垢。水垢主要成分是碳酸钙和氢氧化镁。某兴趣小组为了测定水垢中CaCO3的含量,将6g水垢粉碎后放在烧杯中,然后向其中加入40g某浓度的稀盐酸,使之充分反应(水垢中除碳酸钙和氢氧化镁外都不与稀盐酸反应)。实验数据记录如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
烧杯内所盛物质的总质量/g | 46.0 | 45.2 | 44.8 | 45.1 | 44.1 | 43.9 | 43.8 | 43.8 |
①表中有一数据是不合理的,该数据的测得时间是第 min。
②根据以上数据计算水垢中CaCO3的质量分数(计算结果精确至 0.1%)。