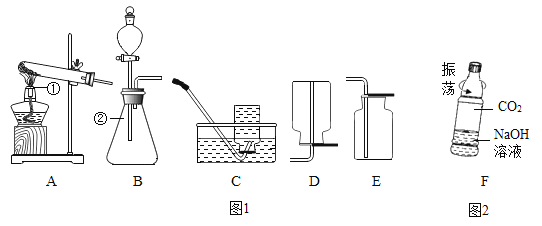
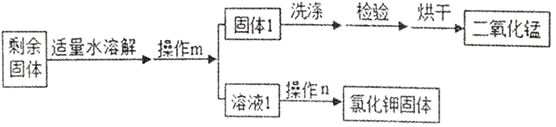
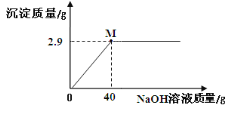
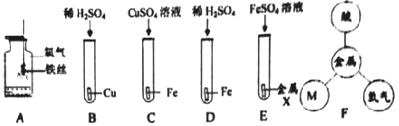
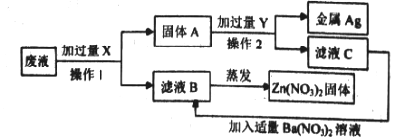
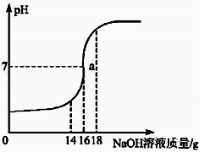
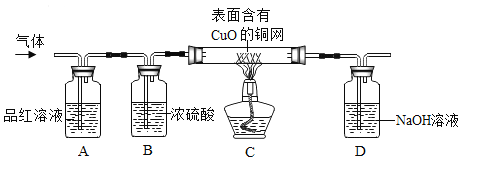
��Ŀ����
����Ŀ�����ᡢ����ε��ܽ��Ա������£�����ѧϰ��ѧ����Ҫ���ߣ��ǻ�С��ͬѧ���øù��߽���̽��ѧϰ��
̽���һ����ʶ����
����ͼ�����б�ע�˼ס��ҡ������������������ʣ����ʵ��ܽ��Ծ�δ������
�����ᡢ����ε��ܽ��Ա������£�
������ ������ | OH�� | NO3�� | Cl�� | SO42�� | CO32�� |
K�� | �� | �� | �� | ||
Ba2�� | �� | �� |
��1����ʶ���ţ�NO3��������___________��
��2��д��ѧʽ�������ʵĻ�ѧʽ��_______________��
��3�����ʷ��ࣺ���������У����ڼ����__________���û�ѧʽ��ʾ����
��4���ܽ����������������У�ֻ��һ�ֲ�����ˮ������____________���û�ѧʽ��ʾ����
̽����������ù���
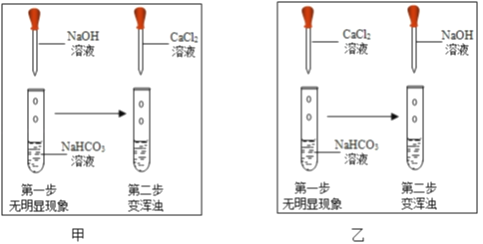
��һ����ɫ��ĩ���ܺ����Ȼ�����̼�ᱵ��̼���ơ��������ƺ��������е�һ�ֻ��֣�ȡһ�����÷�ĩ��Ʒ���뵽ʢ������ˮ���ձ��У����裬���ã��۲쵽�ձ����а�ɫ�����С֣ͬѧ���ձ��е����ʹ��ˣ�������A����ҺB��ȡ����A���Թ��еμӹ���ϡ���ᣬ�۲쵽����ȫ���ܽ⣬�����ݲ�����
С��ͬѧ��һ�����������ʵ�鷽����ȷ����ɫ��ĩ����ɣ�

�������ʵ�鷽���и����������С��ͬѧ����������ֲ�ͬ�ļ��裬����ÿ�ּ����и����費ͬ��ʵ�����ɵó���ͬ��ʵ����ۡ�
����һ | ����� | ������ | |
����һ | �а�ɫ�������� | ||
����� | �ް�ɫ�������� | ��Һ��� | �ܱ�Ϊ��ɫ |
������ | �ް�ɫ�������� | ���������� | ���������� |
��1�����ݼ���һ������ȷ��ԭ��ɫ��ĩ��ֻ����̼�ᱵ��̼���ơ��������ƺ��������������ʡ��������������____________����������������_____________���������з���������һ����ѧ��Ӧ�Ļ�ѧ����ʽ��_________________��
��2�����ݼ����������ԭ��ɫ��ĩ���ܵ������_______________������дһ�ֿ��ܵ���ɣ��û�ѧʽ��ʾ��
��3�����ݼ�����������ԭ��ɫ��ĩ���ܵ������___________�֡�
���𰸡� ����� K2SO4 KOH BaCO3 ��Һ����ɫ��ɺ�ɫ ��Һ�ɺ�ɫ�����ɫ�������ݲ��������������ܽ� BaCO3 + 2HNO3 = Ba(NO3)2 + H2O + CO2�� ��NaOH + HNO3 = NaNO3 + H2O NaOH BaCO3
��NaOH BaCl2 Na2CO3��NaOH BaCl2 BaCO3��NaOH BaCO3 Na2CO3 BaCl2����дһ�ֿ��ܵ���ϣ� 4
��������̽���һ��(1)NO3����������������ӣ�(2)��K+�ɵü�Ԫ�صĻ��ϼ�Ϊ+1�ۣ�SO42���ɵ�������Ļ��ϼ�Ϊ-2�ۣ��������ӽ���γ����ʵĻ�ѧʽ�ǣ�K2SO4��(3)����ָ����ʱ���ɵ�������ȫ�������������ӵĻ�����������������У����ڼ���Ǽף��������أ���ѧʽΪ��KOH��(4)̼�ᱵ������ˮ����ѧʽΪ��BaCO3��̽�������̼�ᱵ������ˮ�������ᣬ̼���ƺ��Ȼ�����Ӧ�����������̼�ᱵ�����������ƺ��Ȼ�����Ӧ���ɲ�����������ᱵ������������ȡһ�����÷�ĩ��Ʒ���뵽ʢ������ˮ���ձ��У����裬���ã��۲쵽�ձ����а�ɫ�����С֣ͬѧ���ձ��е����ʹ��ˣ�������A����ҺB��ȡ����A���Թ��еμӹ���ϡ���ᣬ�۲쵽����ȫ���ܽ⣬�����ݲ��������Է�ĩ��һ�����������ƣ������������ԭ�е�̼�ᱵ���������Ȼ�����̼���Ʒ�Ӧ����̼�ᱵ�������ܺ����������ƣ�������ҺB�п��ܺ����Ȼ�����̼�����е�һ�֣�Ҳ���ܺ��������ƣ��������ƣ�������(1)���ݼ���һ������ȷ��ԭ��ɫ��ĩ��ֻ����̼�ᱵ��̼���ơ��������ƺ��������������ʣ�̼���ơ�������������Һ���Լ��ԣ�̼���ƺ�ϡ���ᷴӦ���ɶ�����̼���壬���Բ��������������Һ���ɫ���������������ǣ������ݲ������������з����ķ�Ӧ���������ƺ����ᷴӦ���������ƺ�ˮ����ѧ����ʽ�ǣ�NaOH+HNO3=NaNO3+H2O��(2)������������ᱵ���ް�ɫ�������ɣ�����B��һ�����������ơ�̼���ƣ������̪����Һ���ɫ��B�п��ܺ���̼���ƻ��������ƣ��μ����ᣬ��Һ��ɫ��������ҺB��һ�������������ƣ�����ԭ��ɫ��ĩ���ܵ�����ǣ�NaOH��BaCO3��(3)������������ᱵ���ް�ɫ�������ɣ�����B��һ�����������ơ�̼���ƣ������̪��û����������B�в�����̼���ƻ��������ƣ��μ����ᣬû����������������ҺB��һ������̼���ƣ�����ԭ��ɫ��ĩ���ܵ�����У�̼�ᱵ�������ƣ�̼�ᱵ���Ȼ�����̼�ᱵ���Ȼ�����̼������̼������������������