题目内容
【题目】实验探究是学习化学的重要方法。
(1)化学兴趣小组的同学足量的锌技加入到浓硫酸a中.发现有大量的气泡放出,他们対气体的成分进行了探究。
【提出问题】锌粒加入浓硫酸后生成的气体是什么?
【查阅资料】①浓硫酸能与锌反应,但不产生氢气,也不会产生氧气;
②SO2有刺激性气味,易溶于水,能使品红(一种红色色素)溶液褪色。
【提出猜想】甲:气体是H2;乙:气体是SO2;丙:气体是SO2和H2;
【实验探究】为了验证上述猜想。同学们在老师的指导下设计了如下图的装置(部分夹持器材略去,假设每个能发生的反应都完全进行)进行探究:
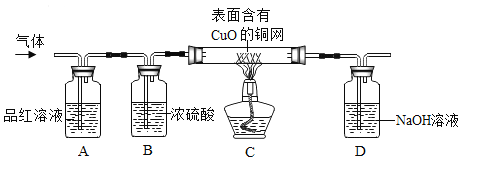
①实验开始后,观察到A中品红溶液褪色,证明气体中含有____。
②B装置的作用是____。
③C装置在点燃酒精灯加热之前应先通一段时间的气体,目的是__;加热一段时间后,观察到_____,证明气体中含有H2。
【讨论】
④锌和浓硫酸反应生成硫酸锌、水和二氧化硫,为什么在反应过程中又产生了氢气呢?用文字简述原因:____。
⑤锌与浓硫酸和稀硫酸反应都可以产生硫酸锌,如果需要制取硫酸锌,用锌与稀硫酸反应的优点是____(任填一种合理的答案)。
(2)碳酸氢钠(NaHCO3)俗称“小苏打”,在生活中用途广泛.某化学实验小组的同学对碳酸氢钠的性质进行探究.
【探究实验1】碳酸氢钠溶液的酸碱性
用试管取适量碳酸氢钠溶液,滴加酚酞试液,振荡,溶液变浅红色.结论:____.
【探究实验2】能与酸反应
取适量碳酸氢钠加入试管中,滴加稀盐酸,再把燃着的木条迅速伸入试管,木条熄灭,碳酸氢钠和盐酸的化学反应方程式:____.
【探究实验3】能与碱反应
查阅资料:NaHCO3+NaOH═Na2CO3+H2O;氢氧化钙微溶于水.用试管取适量碳酸氢钠溶液,滴加氢氧化钠溶液,无明显现象.(提示:可以选择CaCl2溶液做试剂,通过证明有Na2CO3生成,从而证明二者发生了反应)如图,两位同学分别进行了甲、乙两个实验.回答下列问题: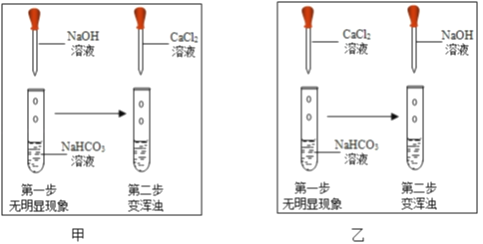
比较甲、乙两个实验的目的性区别是____;
有同学提出两个实验都不足以证明有Na2CO3生成,其理由是____;要证明有Na2CO3生成,还需要进行的操作是____.
【答案】 SO 除去气体中的水蒸气 排除空气 C装置中固体由黑变红 随着反应的进行,浓硫酸逐渐变稀成为稀硫酸 不会产生对空气有污染的气体(答案合理也给分) 碳酸氢钠溶液显碱性 NaHCO3+HCl=NaCl+CO2↑+H2O 甲通过检验产物证明反应发生,而实验乙通过检验反应物证明反应发生 氯化钙与氢氧化钠反应生成氢氧化钙,氢氧化钙微溶于水,在溶液中也产生沉淀 取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有
【解析】本题考查了实验探究物质的性质或变化规律,常见气体的检验与除杂方法,盐的化学性质和化学方程式的书写。
(1)①实验开始后,观察到A中品红溶液褪色,证明气体中含有二氧化硫(SO);
②浓硫酸具有吸水性。B装置的作用是吸收水蒸气;
③氢气与氧气或空气混合,在点燃或加热时易发生爆炸。C装置在点燃酒精灯加热之前应先通一段时间的气体,目的是排除空气防止发生爆炸;氢气与氧化铜在加热时能生成铜和水。加热一段时间后,观察到C装置中固体由黑变红,证明气体中含有H2;
④锌和浓硫酸反应生成硫酸锌、水和二氧化硫,在反应过程中又产生了氢气,原因是:随着反应进行,硫酸浓度减小,当硫酸浓度减小到一定程度时变成稀硫酸,稀硫酸和锌反应生成硫酸锌和氢气。
⑤如果需要制取硫酸锌,用锌与稀硫酸反应的优点是不会产生对空气有污染的气体;
(2)探究实验1:用试管取适量碳酸氢钠溶液,滴加酚酞试液,振荡,溶液变浅红色,说明碳酸氢钠溶液显碱性。
探究实验2:碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学反应方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;
探究实验3:实验甲中氢氧化钠溶液和碳酸氢钠溶液反应生成碳酸钠和水,然后加入氯化钙溶液验证是否有碳酸钠生成,该实验通过检验产物证明反应发生;而实验乙是氯化钙和碳酸氢钠溶液反应生成氯化钠和碳酸氢钙,然后氢氧化钠溶液和碳酸氢钙溶液反应生成碳酸钙沉淀,说明检验反应物来证明反应的发生。比较甲、乙两个实验的目的性区别是:甲是通过检验产物证明反应发生,而实验乙是通过检验反应物来证明反应发生;
有同学提出两个实验都不足以证明有Na2CO3生成,其理由是:氯化钙与氢氧化钠反应生成氢氧化钙,氢氧化钙微溶于水,在溶液中也产生沉淀;要证明有Na2CO3生成,还需要进行的操作是:取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有。

 阅读快车系列答案
阅读快车系列答案【题目】“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
探究活动一:认识工具
如下图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
部分酸、碱和盐的溶解性表(室温)
阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- |
K+ | 甲 | 乙 | 丙 | ||
Ba2+ | 丁 | 戊 |
(1)认识符号:NO3-名称是___________;
(2)写化学式:丙物质的化学式是_______________;
(3)物质分类:五种物质中,属于碱的是__________(用化学式表示);
(4)溶解能力:五种物质中,只有一种不溶于水,它是____________(用化学式表示)。
探究活动二:运用工具
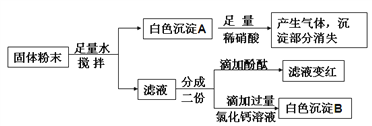
有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物,小郑同学将烧杯中的物质过滤,得滤渣A和滤液B,取滤渣A于试管中滴加过量稀硝酸,观察到滤渣全部溶解,有气泡产生。
小杨同学进一步设计了如下实验方案,确定白色粉末的组成:

针对上述实验方案中各步骤的现象,小杨同学提出下列三种不同的假设,依据每种假设中各步骤不同的实验现象,可得出不同的实验结论。
步骤一 | 步骤二 | 步骤三 | |
假设一 | 有白色沉淀生成 | ||
假设二 | 无白色沉淀生成 | 溶液变红 | 溶变为无色 |
假设三 | 无白色沉淀生成 | 无明显现象 | 无明显现象 |
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质。则步骤二的现象是____________;步骤三的现象是_____________;步骤三中发生的任意一个化学反应的化学方程式是_________________。
(2)依据假设二的现象,原白色粉末可能的组成是_______________;(任写一种可能的组成,用化学式表示)
(3)依据假设三的现象,原白色粉末可能的组成有___________种。