题目内容
【题目】请参与下列探究话动并回答问题
(1)探究金属的性质:
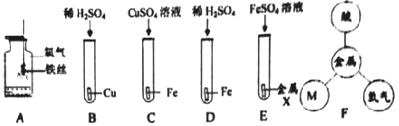
①图A中集气瓶内放少量水的目的____,C中反应的现象为____,D中的反应厲于__(填基本反应类型)
②围B→E中只有B不反应,由实驗可得出氢元索和三种金属话动性由籲射蠲的顺序是_______
③图F中的M属_______(填物质类别)。
(2)认识金属的制备:用一氧化碳还原赤铁矿(主要成分为氣化铁)的化学方程式为____.
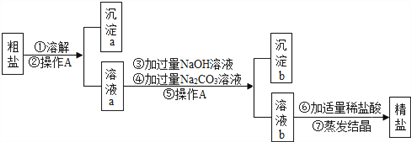
(3)回收废液中金属,某厂排出的废液主要含Zn(NO3)2和AgNO3,为了H牧金緘Ag和Zn(NO3)2,某同学设计了如下实验
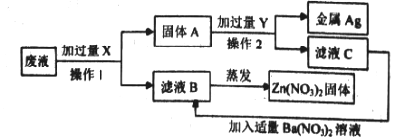
①操作I的名称是__________,加入过量X的目的是__________,
②滤液C的主要成分是__________.
【答案】 防止高温固体落到瓶底使集气瓶炸裂 银白色固体表面生成红色物质,溶液由蓝色变成浅绿色 置换反应 X>Fe>H>Cu 盐 3CO+Fe2O3 ![]() 2Fe+3CO2 过滤 完全置换出废液中的Ag ZnSO4 、H2SO4
2Fe+3CO2 过滤 完全置换出废液中的Ag ZnSO4 、H2SO4
【解析】(1)①图A中集气瓶内放少量水的目的是防止高温固体落到瓶底使集气瓶炸裂;C中反应现象为银白色固体表面生成红色物质,溶液由蓝色变成浅绿色;D中铁和稀硫酸反应生成硫酸亚铁和氢气,属于置换反应;②图B→E中只有B不反应,说明在金属活动性顺序中铜排在铜的后面,铁能和稀硫酸反应,说明铁排在氢的前面,X能和硫酸亚铁反应,说明X排在铁的前面,因此氢元素和三种金属活动性由强到弱的顺序是X>Fe>H>Cu;③图F中的M属于盐,这是因为某些金属单质能和某些盐溶液反应生成另一种金属单质和另一种盐;(2)高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为:3CO+Fe2O3 ![]() 2Fe+3CO2;(3)回收废液中金属:某厂排出的废液主要含Zn(NO3)2和AgNO3,为了从中回收金属银Ag和Zn(NO3)2,某同学设计了如下实验:图2,①操作Ⅰ的名称是过滤;X是锌,加入过量锌的目的是完全置换出废液中的Ag;②Y是稀硫酸,加入过量稀硫酸后,锌和稀硫酸反应生成硫酸锌和氢气,因此滤液C的主要成分是反应生成的硫酸锌和过量的硫酸。
2Fe+3CO2;(3)回收废液中金属:某厂排出的废液主要含Zn(NO3)2和AgNO3,为了从中回收金属银Ag和Zn(NO3)2,某同学设计了如下实验:图2,①操作Ⅰ的名称是过滤;X是锌,加入过量锌的目的是完全置换出废液中的Ag;②Y是稀硫酸,加入过量稀硫酸后,锌和稀硫酸反应生成硫酸锌和氢气,因此滤液C的主要成分是反应生成的硫酸锌和过量的硫酸。

【题目】“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
探究活动一:认识工具
如下图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
部分酸、碱和盐的溶解性表(室温)
阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- |
K+ | 甲 | 乙 | 丙 | ||
Ba2+ | 丁 | 戊 |
(1)认识符号:NO3-名称是___________;
(2)写化学式:丙物质的化学式是_______________;
(3)物质分类:五种物质中,属于碱的是__________(用化学式表示);
(4)溶解能力:五种物质中,只有一种不溶于水,它是____________(用化学式表示)。
探究活动二:运用工具
有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物,小郑同学将烧杯中的物质过滤,得滤渣A和滤液B,取滤渣A于试管中滴加过量稀硝酸,观察到滤渣全部溶解,有气泡产生。
小杨同学进一步设计了如下实验方案,确定白色粉末的组成:

针对上述实验方案中各步骤的现象,小杨同学提出下列三种不同的假设,依据每种假设中各步骤不同的实验现象,可得出不同的实验结论。
步骤一 | 步骤二 | 步骤三 | |
假设一 | 有白色沉淀生成 | ||
假设二 | 无白色沉淀生成 | 溶液变红 | 溶变为无色 |
假设三 | 无白色沉淀生成 | 无明显现象 | 无明显现象 |
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质。则步骤二的现象是____________;步骤三的现象是_____________;步骤三中发生的任意一个化学反应的化学方程式是_________________。
(2)依据假设二的现象,原白色粉末可能的组成是_______________;(任写一种可能的组成,用化学式表示)
(3)依据假设三的现象,原白色粉末可能的组成有___________种。