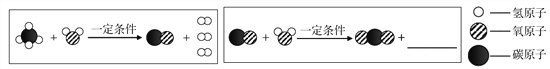
题目内容
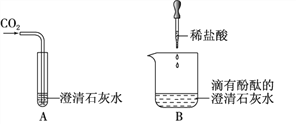
【题目】如图 1 所示是实验室制取氧气的装置图,请按要求回答下列问题
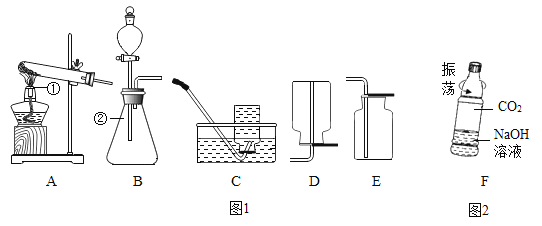
(1)写出图中标号仪器的名称:①____,②_____。
(2)实验室用氯酸钾制取并收集一瓶干燥的氧气,应选用的装置组合是_____(填字母序号)
(3)用氯酸钾和二氧化锰制备氧气时,二氧化锰在反应中的作用是_______, 利用下列流程分离并回收充分反应后的剩余固体,请回答下列问题
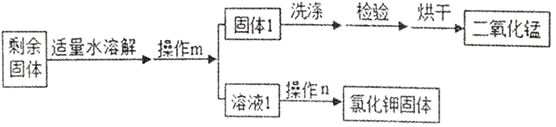
操作 m 的名称是_______ ,操作 m 和操作 n 中都用到的玻璃仪器是________;
(4)实 验 室 用 盐 酸 和 碳 酸 钙 制 二 氧 化 碳 , 该 反 应 的 化 学 方 程 式 为 _________ ;用图 2 中 F 所示的矿泉水瓶进行对比实验,可 以证明 CO2 与 NaOH 溶液确实发生了反应,应做的对比实验是_______;CO2 与 NaOH 溶液反应的化学方程式为___________________ 。
【答案】 酒精灯 锥形瓶 AE 催化作用 过滤 玻璃棒 CaCO3+2HCl=CaCl2+H2O+CO2↑ 取同样大小的一 瓶二氧化碳,倒入与 NaOH 溶液同体积的水,振荡,观察现象 CO2+2NaOH=Na2CO3+H2O
【解析】【解答】(1)①是酒精灯,②是锥形瓶;(2)实验室用氯酸钾制取氧气需要加热,应该用A装置作为发生装置;因为氧气的密度比空气大,可以用向上排空气法收集,即用E装置收集,氧气不易溶于水,可以用排水法收集,即用C装置收集,用排水法收集的氧气不如用排空气法收集的氧气干燥;(3)用氯酸钾和二氧化锰制备氧气时,二氧化锰在反应中的作用是加快氯酸钾的分解速率;操作m的名称是过滤,操作n是蒸发,操作m和操作n中都用到的玻璃仪器是玻璃棒;(4)盐酸和碳酸钙生成氯化钙、水和二氧化碳,该反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;用图2中I所示的矿泉水瓶进行对比实验,可以证明CO2与NaOH溶液确实发生了反应,应做的对比实验是将氢氧化钠溶液换成等体积的蒸馏水作对比实验;CO2与NaOH溶液反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
探究活动一:认识工具
如下图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
部分酸、碱和盐的溶解性表(室温)
阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- |
K+ | 甲 | 乙 | 丙 | ||
Ba2+ | 丁 | 戊 |
(1)认识符号:NO3-名称是___________;
(2)写化学式:丙物质的化学式是_______________;
(3)物质分类:五种物质中,属于碱的是__________(用化学式表示);
(4)溶解能力:五种物质中,只有一种不溶于水,它是____________(用化学式表示)。
探究活动二:运用工具
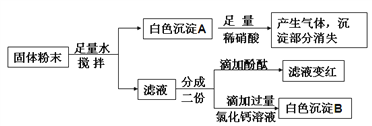
有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物,小郑同学将烧杯中的物质过滤,得滤渣A和滤液B,取滤渣A于试管中滴加过量稀硝酸,观察到滤渣全部溶解,有气泡产生。
小杨同学进一步设计了如下实验方案,确定白色粉末的组成:

针对上述实验方案中各步骤的现象,小杨同学提出下列三种不同的假设,依据每种假设中各步骤不同的实验现象,可得出不同的实验结论。
步骤一 | 步骤二 | 步骤三 | |
假设一 | 有白色沉淀生成 | ||
假设二 | 无白色沉淀生成 | 溶液变红 | 溶变为无色 |
假设三 | 无白色沉淀生成 | 无明显现象 | 无明显现象 |
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质。则步骤二的现象是____________;步骤三的现象是_____________;步骤三中发生的任意一个化学反应的化学方程式是_________________。
(2)依据假设二的现象,原白色粉末可能的组成是_______________;(任写一种可能的组成,用化学式表示)
(3)依据假设三的现象,原白色粉末可能的组成有___________种。