题目内容
【题目】回答下列问题:
(1)实验室配制100g 10%的氯化钠溶液时,需要________g氯化钠固体。称量样品时,应把样品放在托盘天平的_________盘里。
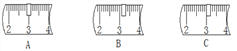
①称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是下图的_____________(填字母)。
②下列仪器中,量取水时需要用到d和____仪器(填序号),溶解时需要用到e和____仪器(填序号)。(每空1分)
a.烧杯、b.10mL量筒、c.100mL量筒、d.滴管、e.玻璃棒、f.药匙、g.蒸发皿。
③为加快食盐的溶解速度,可以采用的方法有:_________________如果配制的溶液的溶质质量分数低于10%,你认为可能原因是____________ 。(任写一个)。
(2)在粗盐提纯中,将氯化钠溶液蒸发至有较多量固体析出后,应_____,_____,利用余热将余下溶液蒸发至干。
【答案】 10 左 B c a 将食盐研磨,加热或搅拌 量取水时仰视刻度,配制溶液的烧杯用少量蒸馏水润洗,氯化钠晶体不纯(答案合理即可) 停止加热(或熄灭酒精灯) 并用玻璃棒不断搅拌
【解析】(1)溶质的质量=溶液的质量×溶质的质量分数;称量药品质量时应注意“左物右码”;①读数时应读游码左边的刻度;②量取液体用到的仪器有量筒和滴管;③根据加快溶解的方法及操作中产生的误差分析解答;(2)蒸发时当有较多量固体析出后,应熄灭酒精灯,停止加热,利用蒸发皿的余热蒸干。(1)实验室配制100g10%的氯化钠溶液时,需要100g×10%g=10g的氯化钠固体;称量样品时,应把样品放在托盘天平的左盘里;①称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是如图的B,读游码左边的刻度;②量取水时需要用到d和100mL量筒,因为要量取的水是90mL,依据一次量取完,且与所量取的液体的体积相近的原则,故选c;③为加快食盐的溶解速度,可以采用的方法有将食盐研磨,加热或搅拌;如果配制的溶液的溶质质量分数低于10%,可能原因是量取水时仰视刻度,配制溶液的烧杯用少量蒸馏水润洗,氯化钠晶体不纯等;(2)在粗盐提纯中,将氯化钠溶液蒸发至有较多量固体析出后,应熄灭酒精灯,并用玻璃棒不断搅拌,利用余热将余下溶液蒸发至干。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
探究活动一:认识工具
如下图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
部分酸、碱和盐的溶解性表(室温)
阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- |
K+ | 甲 | 乙 | 丙 | ||
Ba2+ | 丁 | 戊 |
(1)认识符号:NO3-名称是___________;
(2)写化学式:丙物质的化学式是_______________;
(3)物质分类:五种物质中,属于碱的是__________(用化学式表示);
(4)溶解能力:五种物质中,只有一种不溶于水,它是____________(用化学式表示)。
探究活动二:运用工具
有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物,小郑同学将烧杯中的物质过滤,得滤渣A和滤液B,取滤渣A于试管中滴加过量稀硝酸,观察到滤渣全部溶解,有气泡产生。
小杨同学进一步设计了如下实验方案,确定白色粉末的组成:

针对上述实验方案中各步骤的现象,小杨同学提出下列三种不同的假设,依据每种假设中各步骤不同的实验现象,可得出不同的实验结论。
步骤一 | 步骤二 | 步骤三 | |
假设一 | 有白色沉淀生成 | ||
假设二 | 无白色沉淀生成 | 溶液变红 | 溶变为无色 |
假设三 | 无白色沉淀生成 | 无明显现象 | 无明显现象 |
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质。则步骤二的现象是____________;步骤三的现象是_____________;步骤三中发生的任意一个化学反应的化学方程式是_________________。
(2)依据假设二的现象,原白色粉末可能的组成是_______________;(任写一种可能的组成,用化学式表示)
(3)依据假设三的现象,原白色粉末可能的组成有___________种。