��Ŀ����
����Ŀ�����ڹ�ҵ���ճ�������Ӧ�ù㷺����ش�
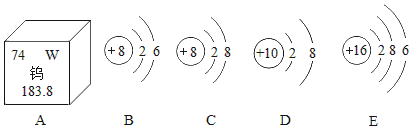
��1��Ԫ������Ȼ����ֲ��������ȣ����ĺ����ӵؿ�������Ԫ�صĵ�_____λ�������Ƴ�������������������չ�Ժ�_____�ԡ�
��2��Ԫ�صĻ�ѧ������ԭ�ӵ����������������й�ϵ����ͼΪ��ԭ�ӵĽṹʾ��ͼ����ԭ���ڻ�ѧ��Ӧ������_____����õ�����ʧȥ�������ӡ�
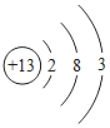
��3�����ڿ�������������Ӧ�����������һ�����ܵ������ﱡĤ���Ӷ���ֹ����һ����������������кܺõĿ���ʴ���ܡ�д������������Ӧ�Ļ�ѧ����ʽΪ��_____��
���𰸡��� ���� ʧȥ 4Al+3O2��2Al2O3
��������
��1���ؿ��к����϶��ǰ����Ԫ�طֱ��������衢���������ƣ���Ԫ��λ�ڵ���λ�������Ƴ�������������������չ�Ժʹ����ԡ�
��2����������������4�������õ��ӣ����������4��������ʧ���ӣ���ԭ���������3�����ӣ������ڻ�ѧ��Ӧ����ʧȥ�����ĵ��ӣ��γ������ӣ�
��3�����ڿ�������������Ӧ�����������һ�����ܵ���������Ĥ����Ӧ�Ļ�ѧ����ʽ�ǣ�4Al+3O2��2Al2O3��
�ʴ�Ϊ����1���������ȣ�
��2��ʧȥ��
��3��4Al+3O2��2Al2O3��

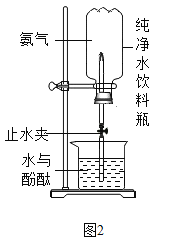
����Ŀ��ʵ��������һƿ��ǩ�������ɫҺ�壬��ͼ��ʾ����ƿ��ɫҺ����ʲô�أ�ʵ��Ա��ʦ���ߴ�ң���Һ��ֻ���ǹ���������Һ��ϡ���������ˮ�е�һ�֡�
��1��������ۺ�һ����Ϊ������������ˮ��������_____��
��2��Ϊȷ����Һ��ɷ֣�ͬѧ�Ǽ�������������ʵ��̽��
ʵ����� | ʵ������ | ʵ����� |
����һ��ȡ��Һ���������Թ��У������м�������_____��ĩ�� | û���������� | ��Һ�岻�ǹ���������Һ |
�������ȡ��Һ���������Թ��У������еμ������Ȼ�����Һ�� | ___ | ��Һ����ϡ���� |
��3��С��Ϊ�˽�һ��֤����������ȷ�ģ���ѡ����ɫʯ����Һ����ʵ�飬ʵ���п�����������_____��֤��ʵ����۳�����
����˼������
��1�������Ϊ��ǩ�����ԭ�������_____��
��2��д��������ķ�Ӧ����ʽ_____��
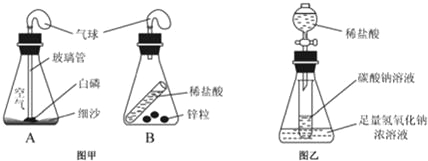
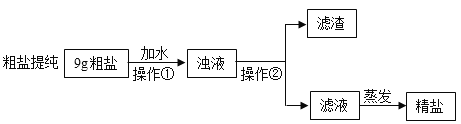
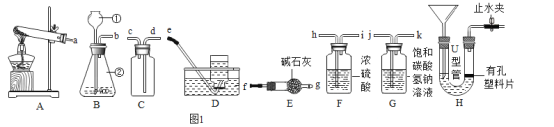
����Ŀ����ͼ��ʾ���ᴿ���ε�ʵ�飬�����к��н϶�Ŀ��������ʣ�CaCl2��MgCl2���Ͳ��������ʣ���ɳ�ȣ����������ʵ��ش���������
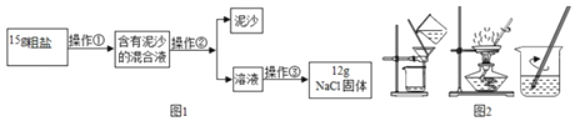
��1��ʵ���еIJ���������Ϊͼ2�е�_____��
��2�����õ���NaCl������ʵ��ֵƫ�ͣ�ԭ����_____��
��3��������������NaCl����_____������
��4��С���Ǹ���ѧϰ��ѧ�����Ի�ѧ��������Ȥ������֪���ᴿ���NaCl�����Ƿ�Ϊ��������������ѧ֪ʶ����������±���
ʵ�鲽�� | ʵ������ | ʵ����� |
_____ | _____ | _____ |
��5��д�����⣨4��ʵ�����йصĻ�ѧ����ʽ_____���÷�Ӧ����������_____��