��Ŀ����
����Ŀ���ճ�ʹ�õĽ������ϣ���������ںϽ𡣻�ͭ����п����Ҫ����Ԫ�ص�ͭ�Ͻ�
��1����ͭ��Cu2O�����ҹ��Ŵ���ȡ��ͭ��һ��ԭ�ϡ�Cu2O��ͭԪ������Ԫ�ص���������_____��
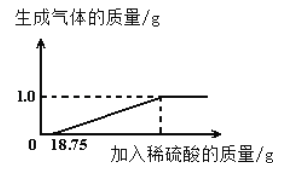
��2���������쵯�ǵĻ�ֻͭ����п��ͭ����22g���Ƿ���ʢ��100gϡ������ձ��У������������������Dz����ܽ���ձ��л�����������121.8g�����㣺
����������������_____��
��������ͭ������_____��
��Ӧ��������Һ��ZnSO4 ������_____��
���𰸡�8��1 0.2g 15.5g 16.1g
��������
��1��Cu2O��ͭԪ������Ԫ�ص��������ǣ���64��2����16��8��1��
��2������ͭ�е�ͭ�������ᷴӦ������������п����ϡ���ᷴӦ�������������������غ㶨�ɿ��������ձ������ʵ�����֮�������������������������ͼ�����ݿ�֪������Ϊ22g+100g��121.8g��0.2g��
���跴Ӧ��п��������x����������п��������y
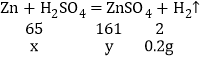
![]()
x��6.5g��y��16.1g
������ͭ��������22g��6.5g��15.5g��
�ʴ�Ϊ����1��8��1����2��������������������0.2g����������ͭ��������15.5g������Ӧ��������Һ��ZnSO4����������16.1g��

 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�