��Ŀ����
����Ŀ��ѧ�����ʵķ����ᴿ��ȷ����һ��������������Һ��ʵ��Ӧ��������Ҫ���塣
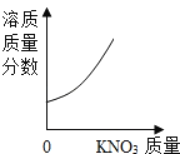
����֪��20���Ȼ��Ƶ��ܽ��Ϊ36g��ˮ���ܶȿɽ��ƿ���1g/mL��
ʵ��һ��������Һ
��1�����Ȼ��ƹ�������100g��������Ϊ5%���Ȼ�����Һ����Ҫ�Ȼ���_____g��
��2��0.9%��ҽ���Ȼ�����Һ�׳�������ˮ�������ڲ��������������ʡ�������ˮ�е�����Ϊ_____��
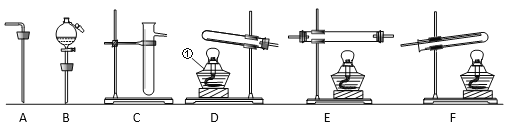
��3����һͬѧ�����õ��Ȼ��ƺ�����ˮ����������������Ϊ 6%���Ȼ�����Һ�����Ʋ��裺����������ȡ���ܽ���������װ���Լ�ƿ���ñ�ǩ������������Һ����ȷ˳����_____������ţ���
ʵ����������к������� CaCl2��MgCl2��Na2SO4 ����ɳ��ijͬѧ���ô�����Ʒ�����ᴿ��
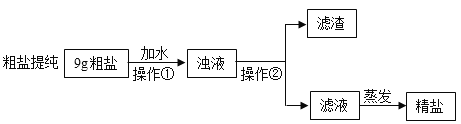
��1���������в�������������_____��������������Ϊ_____��
��2��20��ʱ�ᴿ9g���Σ���֪�������Ȼ��ƺ���ԼΪ80%���ܽ�ʱӦѡ��_____����Ͳ���ṩ����Ͳ����С�10mL������25mL���͡�100mL������ȡ����Ҫ��ˮ��Ϊ���ʡ�
��3���ᴿ��ľ�������_____����������������
��4�������õij�����Һ�����μ����Թ�����_____��Һ��NaOH ��Һ��̼������Һ����ȥ���ɵij������ٵμ��Թ�����ϡ���ᣬ�õ��ϴ����� NaCl ��Һ��
��5��������Һ���õ��϶��Ȼ��ƹ���ʱֹͣ���ȣ���ע�����������_____ֱ�ӷ���ʵ��̨�ϣ������̻�ʵ��̨��
���𰸡�5 �Ȼ��� �ۢ٢ڢ� ����ӿ��ܽ����� ���� 25mL ����� �Ȼ�����Һ ������
��������
ʵ��һ����1�����ʵ���������Һ�����������ʵ�����������100g��5%��5g�����5g��
��2��������ˮ�е�����Ϊ�Ȼ��ƣ�
��3������һ������������������Һʱ��Ӧ���ȼ��㡢��������ȡ���ܽ⡢װƿ����˳��Ϊ���ۢ٢ڢ���
ʵ�������1�����������ܽ���̣����ܽ�ȹ��������ò�������������ܽ⣬Ϊ��ʹ�����Һ�������õķ����ǹ��ˣ�
��2��20��ʱ�ᴿ9g���Σ���֪�������Ȼ��ƺ���ԼΪ80%�������Ȼ�����7.2g��20���Ȼ��Ƶ��ܽ��Ϊ36g����100gˮ���ܽ��Ȼ�������Ϊ36g����ô�ܽ�7.2g�Ȼ�����Ҫ20gˮ�����Ӧ��ѡ��25ml����Ͳ��
��3���ᴿ��ľ����к����Ȼ�þ���Ȼ��ơ�Na2SO4 �ȿ������������ǻ���
��4�������������ƿ��Գ�ȥ�Ȼ��������Ȼ��ƣ�̼���ƿ��Գ�ȥ�Ȼ��������Ȼ��ƣ�Ҫ��ȥ����þ��Ҫѡ���Σ���˿��Լ��Ȼ�����Һ��
��5��������Һ���õ��϶��Ȼ��ƹ���ʱֹͣ���ȣ���ע��������������������ʵ��̨�ϣ���Ϊ���������ȵģ����̻�����̨��
�ʴ�Ϊ��
ʵ��һ
��1��5����2���Ȼ��ƣ���3���ۢ٢ڢ���
ʵ�����
��1������ӿ��ܽ����ʣ����ˣ���2��25mL����3��������4���Ȼ�����Һ����5��������

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д�