题目内容
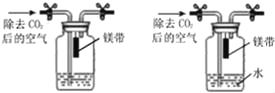
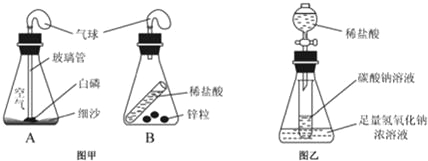
【题目】同学们利用如图所示的装置,对质量守恒定律进行了谈究.实验结束后,老师另外提出了几个问题,请你一起参与思考。
(1)图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是 (选填“A”、“B”或“A和B”)。
(2)若图乙装置内Na2CO3溶液的质量为5克,滴入试管的稀盐酸质量也是5克,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22克,试管中滴入紫色石蕊试液变红。根据上述已知条件,通过分析可以确定的是 (选填序号)。
①原稀盐酸的溶质质量分数 ②原Na2CO3溶液的溶质质量分数
③原NaOH溶液的溶质质量分数 ④反应后试管中NaCl的溶质质量分数
请你选择所填的其中一项,通过计算确定其溶质质量分数是多少?
【答案】
(1)B
(2)②④ 原Na2CO3溶液的溶质质量分数为10.6%
【解析】
试题分析:
(1)A中反应生成的五氧化二磷是固体,B中生成氢气,冷却至室温,B中气球仍胀大,故选B;
(2)试管中滴入紫色石蕊试液变红,可知盐酸过量,碳酸钠全部反应,NaOH浓溶液质量增加0.22克,证明盐酸与碳酸钠反应生成了0.22g二氧化碳气体,根据二氧化碳的质量可计算碳酸钠的质量和生成的氯化钠的质量,进而求得原Na2CO3溶液的溶质质量分数和反应后试管中NaCl的溶质质量分数,故选②④;
设碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 0.22g
![]()
x=0.53g
原Na2CO3溶液的溶质质量分数:![]() =10.6%。
=10.6%。
答:原Na2CO3溶液的溶质质量分数为10.6%。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目