题目内容
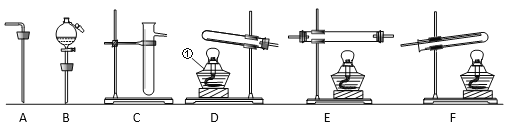
【题目】如图所示是提纯粗盐的实验,粗盐中含有较多的可溶性杂质(CaCl2、MgCl2)和不溶性杂质(泥沙等),请你根据实验回答下列问题
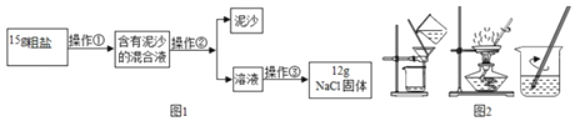
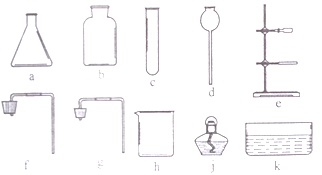
(1)实验中的操作、依次为图2中的_____;
(2)若得到的NaCl产量比实际值偏低,原因有_____;
(3)操作③利用了NaCl具有_____的性质
(4)小明是个爱学习的学生,对化学充满了兴趣,他想知道提纯后的NaCl固体是否为纯净物,请你根据所学知识帮助他完成下表。
实验步骤 | 实验现象 | 实验结论 |
_____ | _____ | _____ |
(5)写出问题(4)实验中有关的化学方程式_____;该反应基本类型是_____。
【答案】溶解、过滤、蒸发 蒸发过程中,氯化钠飞溅 溶解度受温度变化影响较小 取少量提纯后的氯化钠固体加入试管中,加水溶解,再滴加氢氧化钠溶液或碳酸钠溶液,观察实验现象 产生白色沉淀 提纯后的氯化钠是混合物 2NaOH+MgCl2═Mg(OH)2↓+2NaCl 或CaCl2+Na2CO3═CaCO3↓+2NaCl 复分解反应
【解析】
(1)实验中的操作①是溶解,操作②是分离固体为液体,是过滤,操作③是溶液经蒸发得到固体,是蒸发,实验中的操作依次为图2中的溶解、过滤、蒸发;
(2)若得到的NaCl产量比实际值偏低,原因有:蒸发过程中,氯化钠飞溅;
(3)操作③得到氯化钠的方法是蒸发结晶,所以氯化钠具有溶解度受温度变化影响较小的性质;
(4)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,所以
实验步骤 | 实验现象 | 实验结论 |
取少量提纯后的氯化钠固体加入试管中,加水溶解,再滴加氢氧化钠溶液或碳酸钠溶液,观察实验现象 | 产生白色沉淀 | 提纯后的氯化钠是混合物 |
(5)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl 或CaCl2+Na2CO3═CaCO3↓+2NaCl,该反应由两种化合物互相交换成分,生成另外两种化合物的反应,属于复分解反应。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案