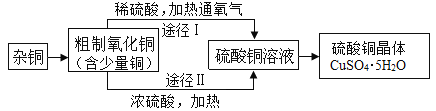
题目内容
【题目】取10g锌粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据。
第1次 | 第2次 | 第3次 | 第4次 | |
加入稀硫酸的质量 | 20g | 20g | 20g | 20g |
剩余固体的质量 | 8.7g | 7.4g | 6.1g | 5.5g |
(1)混合物中铜粉的质量是________。
(2)所用稀硫酸中溶质的质量分数是_____。(保留计算过程)
【答案】5.5g 9.8%
【解析】
铜和硫酸不反应,锌和硫酸反应生成硫酸锌和氢气,每次加入的稀硫酸的质量相等,第1次加入20g稀硫酸固体减少了![]() ,说明20g稀硫酸恰好与1.3g锌反应,第四次加入20g稀硫酸固体减少了
,说明20g稀硫酸恰好与1.3g锌反应,第四次加入20g稀硫酸固体减少了![]() ,则混合物中的锌已经反应完,剩余固体的质量就是混合物中铜的质量,则混合物中铜的质量为5.5g。
,则混合物中的锌已经反应完,剩余固体的质量就是混合物中铜的质量,则混合物中铜的质量为5.5g。
(1)第1次加入20g稀硫酸固体减少了![]() ,说明20g稀硫酸恰好与1.3g锌反应,第四次加入20g稀硫酸固体减少了
,说明20g稀硫酸恰好与1.3g锌反应,第四次加入20g稀硫酸固体减少了![]() ,则混合物中的锌已经反应完,剩余固体的质量就是混合物中铜的质量,则混合物中铜的质量为5.5g。
,则混合物中的锌已经反应完,剩余固体的质量就是混合物中铜的质量,则混合物中铜的质量为5.5g。
(2)第一次加入20g稀硫酸固体减少了![]() ,则20g稀硫酸恰好与1.3g锌反应
,则20g稀硫酸恰好与1.3g锌反应
设第一次参加反应的硫酸的质量为x
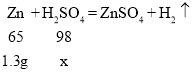
![]()
![]()
所用稀硫酸中溶质的质量分数是![]()
答:所用稀硫酸中溶质的质量分数是9.8%。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】某兴趣小组对面粉厂悬挂“禁止明火”的宣传感到不解。了解到面粉的主成分是淀粉,属于易燃易爆物,完全燃烧产物为CO2和H2O,为了进一步探究面粉的组成,该小组同学设计了以下实验。
(提出问题)面粉主要由哪些元素组成?
(作出猜想)小明猜想:面粉中一定含有C、H元素,他作出此猜想的依据是:_______
小红猜想:面粉中一定含有C、H、O三种元素。
小文认为小红的猜想错误,因为面粉中是否含有氧元素需要实验验证。
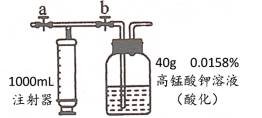
(设计实验)兴趣小组的同学们设计如图所示的实验。
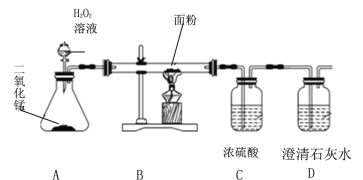
(1)A装置中二氧化锰的作用是___________,发生反应的化学方程式为____________。
(2)打开分液漏斗通入氧气,点燃B处酒精灯。实验现象和结论如下:
实验现象 | 实验结论 |
_______ | ①面粉中含有碳元素 |
B装置硬质玻璃管内壁有水珠出现 | ②面粉中含有氢元素 |
(拓展交流)有同学认为结论②不正确,请说明原因_______
(分析判断)兴趣小组的同学们取面粉8.1 g,使其完全燃烧后测得生成二氧化碳的质量为13.2 g,生成水的质量为4.5 g,由此可以判断出面粉中________(填“含”或“不含”)氧元素。
(反思交流)通过对上述实验分析,为避免事故发生,面粉在生产、运输过程可采取的措施有___。
A 密封门窗,隔绝空气
B 严禁吸烟,杜绝火源
C 轻拿轻放,减少扬尘
D 提高面粉的着火点