题目内容
【题目】探究高锰酸钾的性质
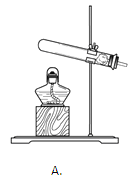
(1)实验室用高锰酸钾制取氧气的化学方程式是______ 。为防止试管破裂,实验中采取的安全措施是______(写一点)。
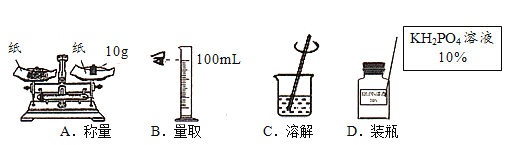
(2)维生素C能使紫色高锰酸钾溶液褪色。常温下,利用如图实验测定苹果汁和橙汁中维生素C含量的相对多少,要得出正确结论,实验过程中需要进行控制的条件有______(填标号)。

A 烧杯中溶液的体积和浓度
B 胶头滴管每次吸取果汁的体积
C 两个胶头滴管滴出的每滴果汁的体积
(3)酸性KMnO4(相对分子质量为158)溶液可以测定居室内甲醛(CH2O)的含量是否超标(国家标准:成人允许的最高浓度为0.1mg/m3)。
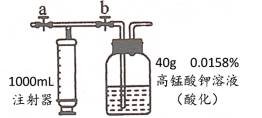
实验步骤如下:
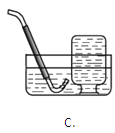
①检查如图装置气密性良好。
②关闭止水夹______(填“a”或“b”,下同),打开______,用注射器抽取新装修的室内空气;接着关闭止水夹______,打开 ______,将气体全部推入酸性高锰酸钾溶液中。重复上述操作,至抽取到空气样品0.5m3与溶液中的高锰酸钾恰好完全反应。
③根据化学方程式计算:该居室内空气中含甲醛的浓度,写出计算过程。
(反应原理为4KMnO4 + 5CH2O + 6H2SO4 == 2K2SO4 + 4MnSO4 + 5CO2 + 11H2O。)
由此判断该居室内甲醛含量______(填“有”或“没有”)超标。
【答案】2KMnO4![]() K2MnO4+MnO2+O2↑ 加热前擦干试管外壁的水(或试管口要略向下倾斜;固定加热前先给试管预热;收集完氧气,先把导管从水槽中取出再停止加热 等合理即可) AC b a a b 超标
K2MnO4+MnO2+O2↑ 加热前擦干试管外壁的水(或试管口要略向下倾斜;固定加热前先给试管预热;收集完氧气,先把导管从水槽中取出再停止加热 等合理即可) AC b a a b 超标
【解析】
(1)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,反应方程式是:2KMnO4![]() K2MnO4+MnO2+O2↑;为防止试管破裂,实验中采取的安全措施是加热前擦干试管外壁的水(或试管口要略向下倾斜;固定加热前先给试管预热;收集完氧气,先把导管从水槽中取出再停止加热 等合理即可);
K2MnO4+MnO2+O2↑;为防止试管破裂,实验中采取的安全措施是加热前擦干试管外壁的水(或试管口要略向下倾斜;固定加热前先给试管预热;收集完氧气,先把导管从水槽中取出再停止加热 等合理即可);
(2)A 本实验根据高锰酸钾溶液褪色现象来判断维生素C含量,因此高锰酸钾溶液的体积和浓度必须相同,属于需要控制的条件,故A正确;
B该对比实验所要记录的数据是果汁的滴数,所滴滴数不同,维生素C含量不同,胶头滴管每次吸取果汁的体积,不需控制,故B错误;
C 该对比实验所要记录的数据是果汁的滴数,所滴滴数不同,维生素C含量不同,因此两个胶头滴管滴出的每滴果汁的体积也要相同,属于需要控制的条件,故C正确。故选AC;
(3)②吸取室内的气体需要通过a开关,将气体推进溶液中需要通过b开关。关闭止水夹b,打开a,用注射器抽取新装修的室内空气;接着关闭止水夹a,打开b,将气体全部推入酸性高锰酸钾溶液中。重复上述操作,至抽取到空气样品0.5m3与溶液中的高锰酸钾恰好完全反应。
③设:与40g高锰酸钾溶液反应需甲醛的质量为x。

![]() x=0.0015g=1.5mg;
x=0.0015g=1.5mg;
居室内空气中含甲醛的浓度=![]() >0.1mg/m3;由此判断该居室内甲醛含量超标。
>0.1mg/m3;由此判断该居室内甲醛含量超标。

【题目】取10g锌粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据。
第1次 | 第2次 | 第3次 | 第4次 | |
加入稀硫酸的质量 | 20g | 20g | 20g | 20g |
剩余固体的质量 | 8.7g | 7.4g | 6.1g | 5.5g |
(1)混合物中铜粉的质量是________。
(2)所用稀硫酸中溶质的质量分数是_____。(保留计算过程)