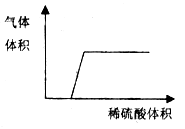
��Ŀ����
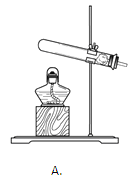
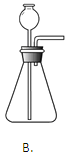
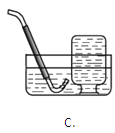
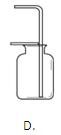
����Ŀ��ʵ����������һ��������A�����п��ܺ��� Na2CO3��BaSO4��NaC1��CuO���������е����ֻ���֡�����ͼ��ʾ����ʵ�飬���ֵ�������ͼ��������(����������п��ܷ����ķ�Ӧ��ǡ����ȫ����)
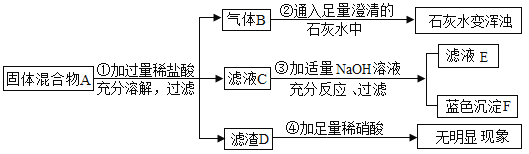
�Ը���ʵ����̺ͷ����������ж�
(1)����������B�Ļ�ѧʽ��___��
(2)д���������������ɫ����F�Ļ�ѧ��Ӧ����ʽ___��
(3)����ҺC�У�һ���������ڵ����������___��
(4)�����A�У�������ȷ�����ڵ�������___(д��ѧʽ)��Ҫ��һ��ȷ�����Ƿ���ڣ����ù�������A����Ʒ������ʵ�飬���Ҫ˵��ʵ��������衢�����������ۣ�___��
���𰸡�CO2 CuCl2+2NaOH��Cu(OH)2��+2NaCl Cl�� NaCl ȡ�����A��������������ˮ�У����ˣ�����Һ�м������ϡ���ᣬ�ٵ���������������Һ���۲죻����а�ɫ�������ɣ������Ȼ��ƣ����û�а�ɫ��������û���Ȼ���
��������
���ᱵ������ˮ���������ᣬ̼���ƺ����ᷴӦ���ɵĶ�����̼��ʹ����ʯ��ˮ����ǣ�����ͭ�����ᷴӦ�����Ȼ�ͭ��ˮ���Ȼ�ͭ���������Ʒ�Ӧ�����Ȼ��ƺ�������ͭ���������Թ�������A�м���ϡ���ᣬ���ɵ�����B��ʹ����ʯ��ˮ����ǣ���B�Ƕ�����̼����Ʒ��һ������̼���ƣ�����D�м���ϡ���ᣬû����������������Ʒ��һ���������ᱵ����ҺC�м����������ƻ�������ɫ������������Ʒ��һ����������ͭ��
(1)����������B�Ļ�ѧʽ�ǣ�CO2��
(2)�������������ɫ����F�ķ�Ӧ���Ȼ�ͭ���������Ʒ�Ӧ����������ͭ�������Ȼ��ƣ���ѧ����ʽΪ��CuCl2+2NaOH��Cu(OH)2��+2NaCl��
(3)����ҺC�У�һ���������ڵ����������Cl����
(4)�����A�У�������ȷ�����ڵ�������NaCl��Ҫ��һ��ȷ�����Ƿ���ڣ����ù�������A����Ʒ������ʵ�飬ʵ��������衢�������������ǣ�ȡ�����A��������������ˮ�У����ˣ�����Һ�м������ϡ���ᣬ�ٵ���������������Һ���۲죻����а�ɫ�������ɣ������Ȼ��ƣ����û�а�ɫ��������û���Ȼ��ơ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ȡ10gп�ۺ�ͭ�۵Ļ�������ձ��У����ձ��з��Ĵμ����������ͬ��ϡ���ᣬʵ������еõ��������ݡ�
��1�� | ��2�� | ��3�� | ��4�� | |
����ϡ��������� | 20g | 20g | 20g | 20g |
ʣ���������� | 8.7g | 7.4g | 6.1g | 5.5g |
��1���������ͭ�۵�������________��
��2������ϡ���������ʵ�����������_____��������������̣�