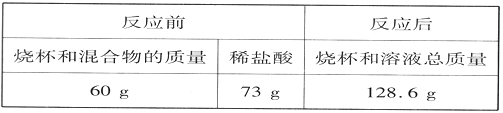
题目内容
【题目】A、B、C、D、E、F分别表示六种物质,它们之间的转化关系如图所示(部分生成物省略)
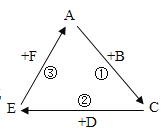
(1)分析图中①②③表示的三种反应,其中不可能发生的基本反应类型是________
(2)如果A是相对分子质量最小的氧化物,B是常用的食品干燥剂,D是植物光合作用必需的气体,则E是____________,反应①的化学方程式是___________________________反应③的化学方程式是__________________
【答案】分解反应 CaCO3 CaO + H2O == Ca(OH)2 CaCO3 + 2HCl ==CaCl2 + H2O + CO2
【解析】
分解反应的特征是“一变多”,根据相对分子质量最小的氧化物是水,常用的食品干燥剂是氧化钙,植物光合作用必需的气体是二氧化碳。
(1)根据分析,可知图中①②③表示的三种反应,A+B→C,C+D→E,E+F→A,三个反应均不符合一种物质生成两种或两种以上物质的反应,不可能发生的是分解反应;
(2)A是相对分子质量最小的氧化物,其物质是水,B是常用的食品干燥剂,即氧化钙,D是光合作用必需的气体,即二氧化碳,反应①是氧化钙和水反应生成氢氧化钙,反应②是氢氧化钙和二氧化碳反应生成碳酸钙和水,则E是碳酸钙,反应①的化学方程式为CaO+H2O═Ca(OH)2;反应③为碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑。

【题目】人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)地壳中含量居第一位的金属元素是______(填元素符号)。
(2)日常使用的金属材料多数属于合金,与组成合金的纯金属相比,合金的优点一般有______(填序号)
①强度更低;②硬度更高;③熔点低;④抗腐蚀性更好
(3)某化学兴趣小组的学生发现金属R不在初中学到的金属活动性顺序表中,该小组为了了解R与常见金属铝、铜的金属活动性顺序,进行如下探究活动;
(作出猜想)他们考虑到铝的活动性比铜强,对三种金属的活动性顺序作出如下猜想:
猜想一:Al>Cu>R;
猜想二______
猜想三:R>Al>Cu
(查阅资料)R是一种银白色的金属,在R的盐溶液中只有+2价,R的盐溶液呈蓝色,常温下铝的表面会形成一层致密的氧化膜:硫酸铝、氧化铝、硝酸铝的溶液均为无色。
(实验探究)为了探究哪一种猜想成立,甲、乙、丙三名同学分别针对猜想一、猜想二、猜想三设计实验方案并展开实验探究。
猜想 | 主要操作 | 主要现象 | 实验结论 |
猜想一 | 打磨R丝,并将其插入到硫酸铜溶液中 | R丝表面覆盖了一层红色的物质 | 猜想一 ______ (填“成立”或“不成立”) |
猜想二 | 打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中 | ①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色 ②铝丝表面产生气泡较快 ③铜丝表面没有气泡产生 | 猜想二成立。 R与稀硫酸反应的化学方程式为______ |
猜想三 | ______ | 无明显现象 | 猜想三成立 |
(交流反思)
究竟哪种猜想成立?三名同学经讨论交流发现丙同学在实验前没有打磨铝丝,这可能会导致实验结论错误。于是他们先打磨铝丝,再将其插入到丙同学做实验用过的溶液中,一段时间后溶液的颜色______;进而确认猜想三不成立,猜想二成立。
(4)为了测定铜锌合金样品中锌的质量称取样品20g于烧杯中,向其中加入50g稀硫酸至恰好完全反应反应后烧杯中物质的总质量为69.8g。请计算:样品中锌的质量。______
【题目】兴趣小组同学为了测定某中碳酸钙的质量分数,称取25.0g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 | 第1次 | 第2次 | 第3次 | 第4次 |
剩余固体质量(g) | 21.6 | 19.2 | 16.2 | 16.2 |
试计算:
(1)完全反应后生成二氧化碳的质量是__g。
(2)求珍珠粉中碳酸钙的质量分数。(写出计算过程)__________.