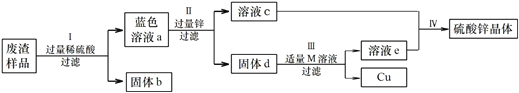
题目内容
【题目】有一包固体A,可能含有Cu(OH)2、CuO、Cu、NaOH、Na2CO3、CaCl2中的几种,取少量的A做如下实验,现象如图所示。

根据实验过程中的现象判断:
(1)沉淀G是_____(填化学式,下同)。
(2)溶液F中,一定存在溶质是_____。
(3)滤液B中,可能存在的溶质是_____,若要证明该物质是否存在,应补做的实验是(写出主要实验步骤、现象及结论)_____。
【答案】 Cu H2SO4、CuSO4 NaOH 取B的溶液加入过量的氯化钡溶液,充分反应后过滤,取上层清液滴加酚酞变红色则证明含NaOH
【解析】由于原固体中只有碳酸钠能和稀盐酸反应生成二氧化碳气体,也只有铜不溶于水,也不溶于稀硫酸,故气体D是二氧化碳,沉淀G是铜;由于原固体中一定含有碳酸钠和铜,而碳酸钠能和氯化钙反应生成碳酸钙沉淀,两物质不能共存,而且沉淀C和稀硫酸反应并没有气泡冒出,说明原固体中一定没有氯化钙,往沉淀C中加入过量的稀硫酸,得到蓝色溶液和沉淀G,说明一定有氧化铜和氢氧化铜的一种或两种,但无法确定氢氧化钠的存在。
(1)沉淀G是是铜,表示为Cu;
(2)蓝色溶液中一定含有生成的硫酸铜,由于稀硫酸是过量的,因此蓝色溶液中还有硫酸。硫酸铜表示为CuSO4;稀硫酸表示为H2SO4;
(3)由于氢氧化铜、氧化铜、铜都不能溶于水,也不和其他物质发生反应,因此滤液B中可能还有氢氧化钠,氢氧化钠表示为NaOH;取溶液B少许滴加过量的BaCl2溶液将碳酸钠除去后或过滤,取上层清液滴入酚酞,若变红色则含有NaOH,反之则无NaOH。

【题目】某同学利用如下实验研究酸的性质,并进行未知物检验。
序号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
现象 | 红色固体消失,溶液变黄 | 固体表面有气泡产生,澄清石灰水变浑浊 | ||
(1)进行实验①、②的目的是________。
(2)依据实验③、④的现象,可得出关于方解石和云白石成分的结论是________。