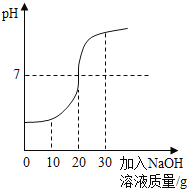
题目内容
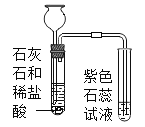
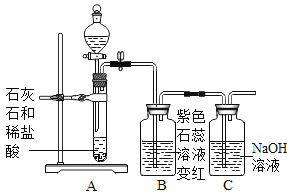
【题目】甲同学用如图所示装置制得CO2,并验证CO2性质的实验。
(1)制取二氧化碳反应的化学方程式是_____。
(2)乙同学在实验时闻到制得的CO2有些刺激性气味,于是乙同学对气味的来源以及能使紫色石蕊溶液变红的酸性物质产生了疑问。
(乙同学的猜想)甲同学用的盐酸浓度大或者产生气体流速大导致氯化氢逸出。
甲、乙两同学经过认真设计、反复思考,设计如下实验来解决乙同学的疑问:
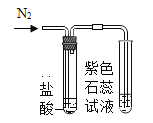
(进行实验)实验装置如下(两个实验中所用盐酸及紫色石蕊溶液与上图中所用的盐酸和石蕊溶液一样,且酸的体积和石蕊的体积都相同,夹持装置已略去)。
实验1 | 实验2 |
|
|
紫色石蕊试液变红 | 紫色石蕊试液无变化 |
(实验解释)
①乙同学进行猜想与假设的依据是_____。
②老师提示如果用实验1制取二氧化碳并验证二氧化碳与水反应,需要在两个试管之间增加装置。该装置的作用是_____,该装置中盛放的药品应具有的性质是_____。
③实验2的结论是_____。
(3)上图的C装置是想验证二氧化碳与氢氧化钠反应,实验过程中看到瓶内不断有气泡产出,但溶液始终没有明显变化,所以得不到正确的结论。
实验结束后,老师把A试管中的液体全部倒入C瓶,发现开始有气泡产生,后来产生白色沉淀。产生沉淀反应的化学方程式是_____。由此间接证明了二氧化碳能与氢氧化钠能反应
(实验结论)二氧化碳能与水、氢氧化钠反应。
(反思)实验室制取二氧化碳只能用稀盐酸,用浓盐酸的后果是_____。
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ 浓盐酸具有挥发性(或氯化氢气体具有刺激性气味) 除去氯化氢气体 既能除去氯化氢气体又不产生其他有干扰性的气体,且不和二氧化碳反应 产生的二氧化碳有刺激性气味与气体的流速无关(或盐酸的挥发与气体的流速无关) Na2CO3+CaCl2=2NaCl+CaCO3↓ 得到的二氧化碳不纯
【解析】
碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,碳酸钠和氯化钙反应生成碳酸钙和氯化钠。
(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为
![]() 。
。
(2)①乙同学进行猜想与假设的依据是浓盐酸具有挥发性(或氯化氢气体具有刺激性气味)。
②了为防止挥发出来的氯化氢气体干扰二氧化碳的检验,应该需要在两个试管之间增加一个既能除去氯化氢气体又不产生其他有干扰性的气体,且不和二氧化碳反应的装置。
③通过实验2的现象可以提出如下结论:产生的二氧化碳有刺激性气味与气体的流速无关(或盐酸的挥发与气体的流速无关)。
(3)碳酸钠和氯化钙反应生成氯化钠,化学方程式为![]() 。
。
[反思]因为浓盐酸具有挥发性,使得到的二氧化碳不纯。