题目内容
【题目】烧杯中盛有一定质量的氧化镁和氧化铁的固体混合物,向其中加入稀盐酸 100 g,恰好完全反应,得到该温度下的不饱和溶液 120 g。再向其中加入足量氢氧化钠溶液,充分反应后过滤,将沉淀洗涤、干燥、称量,其示数为 27.2 g。则下列相关计算中,不正确的是( )。
A.原固体中金属元素质量为 13.6gB.所用盐酸的溶质质量分数为 29.2%
C.最终所得溶液中含有 NaCl 58.5gD.实验中消耗的氢氧化钠质量为 32g
【答案】C
【解析】
根据MgO、Fe2O3和酸反应及与碱反应的关系,找出增量,以MgO为例:
![]()
设所用盐酸的溶质质量分数为x,氢氧根的质量为y,实验中消耗的氢氧化钠质量为z,最终所得溶液中含有NaCl的质量为m,则:
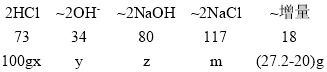
x=29.2%
y=13.6g
z=32g
m=46.8g
原固体中金属元素质量为 27.2g-13.6g=13.6g,故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某碳酸钠样品中含有一定量的碳酸氢钠。为测定其纯度,取100 g样品加热至不再产生气体(2NaHCO3![]() Na2CO3 + H2O +CO2↑),使生成的二氧化碳完全被碱石灰吸收,测得加热时间和碱石灰质量增加的关系如下表:
Na2CO3 + H2O +CO2↑),使生成的二氧化碳完全被碱石灰吸收,测得加热时间和碱石灰质量增加的关系如下表:
时间 | 0分钟 | 1分钟 | 2分钟 | 3分钟 | 4分钟 |
仪器和碱石灰的质量总和(g) | 150 | 151.5 | 153 | 154.4 | 154.4 |
(1)当完全反应后,生成二氧化碳的质量为_____g
(2)样品中碳酸钠的质量分数是_____(写出计算过程)
(3)取另一品牌的碳酸钠样品(也含一定量的碳酸氢钠)29.6g与100g18.25%的稀盐酸恰好完全反应,将溶液蒸干可得晶体的质量为________g。
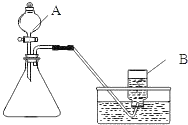
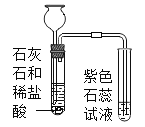
【题目】甲同学用如图所示装置制得CO2,并验证CO2性质的实验。
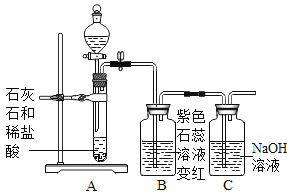
(1)制取二氧化碳反应的化学方程式是_____。
(2)乙同学在实验时闻到制得的CO2有些刺激性气味,于是乙同学对气味的来源以及能使紫色石蕊溶液变红的酸性物质产生了疑问。
(乙同学的猜想)甲同学用的盐酸浓度大或者产生气体流速大导致氯化氢逸出。
甲、乙两同学经过认真设计、反复思考,设计如下实验来解决乙同学的疑问:
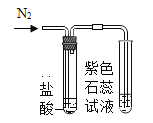
(进行实验)实验装置如下(两个实验中所用盐酸及紫色石蕊溶液与上图中所用的盐酸和石蕊溶液一样,且酸的体积和石蕊的体积都相同,夹持装置已略去)。
实验1 | 实验2 |
|
|
紫色石蕊试液变红 | 紫色石蕊试液无变化 |
(实验解释)
①乙同学进行猜想与假设的依据是_____。
②老师提示如果用实验1制取二氧化碳并验证二氧化碳与水反应,需要在两个试管之间增加装置。该装置的作用是_____,该装置中盛放的药品应具有的性质是_____。
③实验2的结论是_____。
(3)上图的C装置是想验证二氧化碳与氢氧化钠反应,实验过程中看到瓶内不断有气泡产出,但溶液始终没有明显变化,所以得不到正确的结论。
实验结束后,老师把A试管中的液体全部倒入C瓶,发现开始有气泡产生,后来产生白色沉淀。产生沉淀反应的化学方程式是_____。由此间接证明了二氧化碳能与氢氧化钠能反应
(实验结论)二氧化碳能与水、氢氧化钠反应。
(反思)实验室制取二氧化碳只能用稀盐酸,用浓盐酸的后果是_____。