题目内容
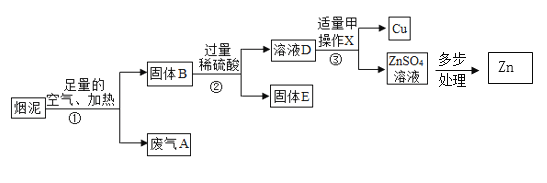
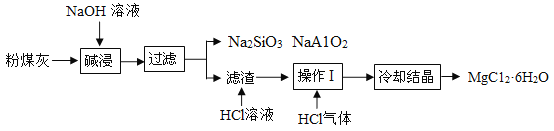
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、MgO等。研究小组对其进行综合处理的流程如图:
资料1:SiO2、Al2O3溶于浓氢氧化钠溶液。
资料2:MgCl2溶液加热容易水解生成Mg(OH)2
(1)“碱浸”时SiO2(性质与CO2 相似)的化学方程式为_____。
(2)粉煤灰碱浸需要在较高温度下进行,原因是_____。
(3)滤渣中加入稀盐酸发生的化学方程式是_____。
(4)操作Ⅰ是_____。通入HCl气体的目的是_____。
(5)火力发电易造成较大污染,人们现在开发和应用的清洁能源有_____(写出一种即可)。
【答案】SiO2+2NaOH=Na2SiO3+H2O 加快反应,提高SiO2 、Al2O3的浸出率 MgO+2HCl=MgCl2+H2O 蒸发浓缩 防止MgCl2和水反应损失 太阳能(答案合理即可)
【解析】
本题主要考察工业流程问题的相关知识
(1)SiO2与NaOH溶液反应原理(CO2和NaOH 反应同理):SiO2+2NaOH=Na2SiO3+H2O
(2)升高温度,可以加快反应速度,提高SiO2 、Al2O3的浸出率
(3)氧化镁与盐酸反应原理:MgO+2HCl=MgCl2+H2O
(4)操作Ⅰ是蒸发浓缩,形成氯化镁的饱和溶液;氯化镁在加热的条件下容易与水发生反应,通入氯化氢气体是为了防止MgCl2和水反应损失
(5)太阳能、风能、潮汐能、氢气、乙醇等

 世纪百通期末金卷系列答案
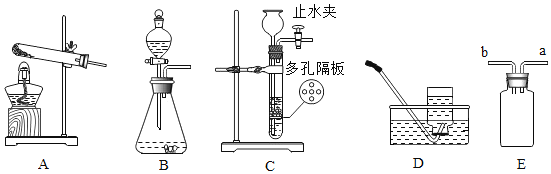
世纪百通期末金卷系列答案【题目】甲同学用如图所示装置制得CO2,并验证CO2性质的实验。
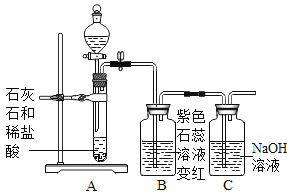
(1)制取二氧化碳反应的化学方程式是_____。
(2)乙同学在实验时闻到制得的CO2有些刺激性气味,于是乙同学对气味的来源以及能使紫色石蕊溶液变红的酸性物质产生了疑问。
(乙同学的猜想)甲同学用的盐酸浓度大或者产生气体流速大导致氯化氢逸出。
甲、乙两同学经过认真设计、反复思考,设计如下实验来解决乙同学的疑问:
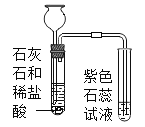
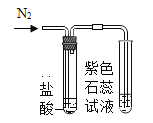
(进行实验)实验装置如下(两个实验中所用盐酸及紫色石蕊溶液与上图中所用的盐酸和石蕊溶液一样,且酸的体积和石蕊的体积都相同,夹持装置已略去)。
实验1 | 实验2 |
|
|
紫色石蕊试液变红 | 紫色石蕊试液无变化 |
(实验解释)
①乙同学进行猜想与假设的依据是_____。
②老师提示如果用实验1制取二氧化碳并验证二氧化碳与水反应,需要在两个试管之间增加装置。该装置的作用是_____,该装置中盛放的药品应具有的性质是_____。
③实验2的结论是_____。
(3)上图的C装置是想验证二氧化碳与氢氧化钠反应,实验过程中看到瓶内不断有气泡产出,但溶液始终没有明显变化,所以得不到正确的结论。
实验结束后,老师把A试管中的液体全部倒入C瓶,发现开始有气泡产生,后来产生白色沉淀。产生沉淀反应的化学方程式是_____。由此间接证明了二氧化碳能与氢氧化钠能反应
(实验结论)二氧化碳能与水、氢氧化钠反应。
(反思)实验室制取二氧化碳只能用稀盐酸,用浓盐酸的后果是_____。