题目内容
【题目】A-H 为初中化学常观物质。其中 A、E 为氧化物且 E 为常见的液体,B、D 为碱,H、G 为单质,C为石灰石的主要成分,F 为胃酸的主要成分,反应 A→G 为光合作用。它们之间的相互关系如下图所示。其中“→“表示转化关系,“一”表示相互之间能发生反应(部分反应物、生成物以及反应条件省略)。请回答下列问题:

(1)E 的化学式为_____, G 的化学式为_____
(2)反应③的基本反应类型为_____
(3)写出下列反应的化学方程式:
① _____;②_____ ;③_____
【答案】H2O O2 复分解反应  CO2+Ca(OH)2=CaCO3↓+H2O Ca(OH)2+ Na2CO3=2NaOH+ CaCO3↓
CO2+Ca(OH)2=CaCO3↓+H2O Ca(OH)2+ Na2CO3=2NaOH+ CaCO3↓
【解析】
此类题型是中考中的一个常见难题、拉分题。主要难在将初中化学所学综合,多角度去分析。因此要求学生对常见物质的物理化学性质,可能发生的反应的方程式要有深刻的记忆,故这一类型的题目较难,但题目会有非常明显的突破口。
根据题目可知“E为常见的液体”得E为H2O;“B、D 为碱,H、G 为单质”告诉我们B、D、H、G的分类;“C为石灰石的主要成分”,则C为CaCO3,而能生成碳酸钙的碱只有Ca(OH)2,可知B为Ca(OH)2;继续由B→D,及由Ca(OH)2得到的碱只有NaOH,则D为NaOH;由“F 为胃酸的主要成分”得F为HCl;F→H表示能由HCl得到的单质,单质只能是H2,故H为H2;最后得知A→G为光合作用,光合作用的反应物中水已经是E了,因此A只能是CO2,G可以和H2反应,所以G是O2。
故得A:CO2、B:Ca(OH)2、C:CaCO3、D:NaOH、E:H2O、F:HCl、G:O2、H:H2
则A→G的反应为光合作用,方程式为
A与B的反应为CO2与Ca(OH)2的反应,方程式为CO2+Ca(OH)2=CaCO3↓+H2O
B→D的反应时复分解反应,方程式为Ca(OH)2+ Na2CO3=2NaOH+ CaCO3↓
故答案为H2O;O2;复分解反应; ;CO2+Ca(OH)2=CaCO3↓+H2O;Ca(OH)2+ Na2CO3=2NaOH+ CaCO3↓
;CO2+Ca(OH)2=CaCO3↓+H2O;Ca(OH)2+ Na2CO3=2NaOH+ CaCO3↓

 黄冈创优卷系列答案
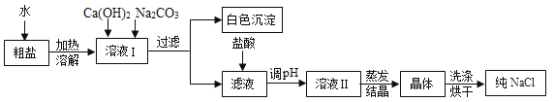
黄冈创优卷系列答案【题目】某化学兴趣小组围绕“酸和碱的中和反应”的学习,进行了如下实验:
实验一:取5mL氢氧化钠溶液于烧杯中,滴入几滴酚酞溶液,可观察到现象为_____,然后加入稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的反应方程式为_____。
实验二:对实验一反应后溶液中的溶质进行探究。
(提出猜想)
猜想一:只有NaCl
猜想二:有NaCl和NaOH
猜想三:有NaCl和HCl
你认为猜想_____不合理,其理由是_____。
(设计实验)
实验操作 | 实验现象 | 实验结论 |
取反应后的溶液于试管中,加入_____ | _____ | 猜想三成立 |
(拓展应用)我国土壤的酸碱性有“南酸北碱”之说法,你认为需向酸性土壤中加入_____进行改良。