题目内容
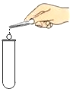
【题目】实验室常用下列如图1装置制取气体,请你根据所学知识回答下列问题。
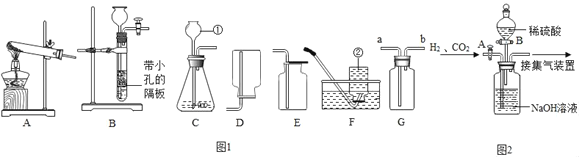
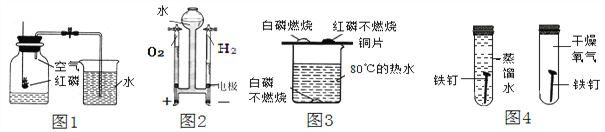
(1)写出编号所指仪器的名称:①_____;②_____。
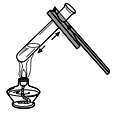
(2)小李在实验室中用高锰酸钾制取氧气,他选择的发生装置是_____(填序号,下同),收集装置是_____。小红在实验室中选用C装置作为氧气的发生装置,请你写出小红制取氧气的化学反应方程式:_____。
(3)实验室选用C和E装置还可以制取的气体是_____(填化学式),写出实验室制取该气体的化学方程式_____。
(4)装置B、C都可以用来制取(3)中的气体,比较这两个装置的不同,指出B装置的一个突出优点:_____。
(5)有一名同学欲用G装置收集H2,则H2应从导管口_____通入。
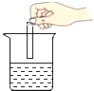
(6)工业常需分离H2、CO2的混合气体。某同学采用图2所示的装置也能达到分离该混合气体的目的。操作步骤如下:
①关闭活塞B,打开活塞A,通入混合气体,可收集到_____气体。
②然后,_____(填操作),又可收集到另一种气体。
【答案】长颈漏斗 集气瓶 A E或F 2H2O2![]() O2↑+2H2O CO2 CaCO3+2HCl=CaCl2+H2O+CO2↑ 控制反应的开始与结束 b H2 关闭活塞A,打开活塞B
O2↑+2H2O CO2 CaCO3+2HCl=CaCl2+H2O+CO2↑ 控制反应的开始与结束 b H2 关闭活塞A,打开活塞B
【解析】
(1)由图可知,仪器①的名称是长颈漏斗,故填长颈漏斗;
仪器②的名称是集气瓶,故填集气瓶。
(2)用高锰酸钾制氧气的反应物是固体,还需要加热,应选择固体受热发生装置,即装置A,故填A;
氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,故填E或F;
选用C装置作为氧气的发生装置,反应是过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气,故反应的化学方程式写为:2H2O2![]() O2↑+2H2O。
O2↑+2H2O。
(3)实验室制取CO2是在常温下,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,不需要加热,二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集故填CO2;
碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,故反应的化学方程式写为:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(4)B装置的一个突出优点是通过控制玻璃开关的开闭,来控制反应的开始与结束,故填控制反应的开始与结束。
(5)用G装置收集H2时,因为氢气的密度比空气的密度小,则H2应从短管进入瓶中,故填b。
(6)①关闭活塞B,打开活塞A,通入混合气体,气体中的二氧化碳与瓶中的氢氧化钠溶液反应生成碳酸钠和水,从瓶中导出的气体为氢气,可收集到氢气,故填H2;
②关闭活塞A,打开活塞B,长颈漏斗中流下的稀硫酸与瓶中生成的碳酸钠反应生成硫酸钠、水和二氧化碳,又可收集到二氧化碳,故填关闭活塞A,打开活塞B。

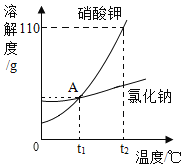
【题目】下表提供了硝酸钾固体在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
(1)20℃时,向50 g水中加入20 g硝酸钾,充分溶解后得到__________(选填:饱和或不饱和)溶液,溶液的溶质质量分数为_________(保留一位小数)。
(2)现有60℃时的硝酸钾饱和溶液210 g,若降温至20℃,析出硝酸钾晶体的质量是____,通过________操作可将析出的硝酸钾晶体和溶液分离。
(3)现有80℃时溶质质量分数为30%的硝酸钾溶液,则降温到________(填字母)能得到硝酸钾针状晶体。
a. 0℃-20℃ b. 20℃-40℃ c. 40℃-60℃ d. 60℃-80℃
(4)用100g10%的硝酸钾溶液配制5%的硝酸钾溶液。需要加水_______亳升(水的密度为1.0g·mL-1)
【题目】某品牌矿泉水的标签上标明的矿泉水主要成分如下表所示,请根据下表回答下列问题:
水质主要成分(mgL﹣1) | |||
偏硅酸(H2SiO3) | 28.9~42.9 | 锶(Sr2+) | 0.01~0.32 |
碳酸氢根 | 173~205 | 钙 | 5~45 |
氯 | 1.0~8.0 | 钠 | 45~70 |
硫酸根 | 16.06~19.5 | 钾 | 0.5~2.0 |
镁 | 2.5~7.5 | pH | 7.8±0.5 |
(1)两个硫酸根离子的化学符号是_____。
(2)碳酸氢钙的化学式是_____。
(3)用结构示意图表示C1﹣的核外电子排布:_____。
(4)偏硅酸中硅元素的化合价是_____。
【题目】超市出现了一种含“污渍爆炸盐”的新产品(如图),能清除衣服上难以清洗的汗 渍、果汁渍。它的特殊的名称让小明对它产生了探究的兴趣。

(1)小明在超市的___区域购买了此产品。
(2)阅读产品标签:“污渍爆炸盐”是一种衣物助洗剂,主要成分是过碳酸钠,能在瞬间去除洗衣液难以除去的多种顽固污 渍……,本产品不伤衣物,无磷是它的一大优点。含磷洗涤剂对环 境的危害是______。
(3)查阅资料:过碳酸钠(Na2CO4)是白色结晶颗粒,溶于水 会产生碳酸盐和其它化合物。
(4)合理猜想其它化合物为:
i. NaOH;ii. H2O2;iii. NaOH 和 H2O2;小明做出以上猜想的理论依据是___。
(5)实验设计:探究“污渍爆炸盐”水溶液的成分,完成下列表格。 已知:Mg(OH)2 是难溶于水的白色固体。
实验步骤 | 实验现象 | 实验结论 |
步骤 1:取少量“污渍爆炸盐”于烧杯中,加入足量蒸馏水,充分搅拌。 | 固体完全溶解,形成无色溶液 | |
步骤 2:取少量步骤 1 形成的溶液于试管中,再加 入___ , 振荡,静置。 | 白色沉淀 | 含有 Na2CO3 |
步骤 3:取少量步骤 2 试管中的上层清液于另一支 试管中,再滴加少量 MgCl2 溶液,振荡。 | 无明显现象 | ___ |
步骤 4:另取一支试管,加入少量步骤 1 形成的溶 液,再加入__ , 将带火星木条伸入试管中。 | ___ | 含有 H2O2 |
(6)实验结论:猜想__ 正确。写出过碳酸钠与水反应的化学方程式:____ 。