题目内容
【题目】(1)已知:水的密度为1.0g/mL,实验室配制50g溶质质量分数为5%的氯化钠溶液,需要称取氯化钠2.5g,需要量取水_____。
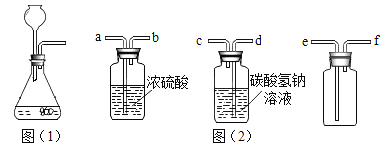
(2)配制的操作示意图如下,该实验的正确操作顺序为_____(填字母序号)。
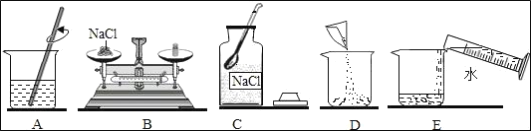
(3)上述步骤A中玻璃棒的作用是_____。
(4)经检测,所配制溶液的溶质质量分数偏小,其原因可能是_____(填序号)。
①氯化钠固体不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出。
【答案】47.5mL CBDEA 搅拌,加快氯化钠的溶解速率 ①②③
【解析】
![]() ,
,![]() 。
。
(1)实验室配制50g溶质质量分数为5%的氯化钠溶液,需要称取氯化钠![]() ,需要量取水的质量为
,需要量取水的质量为![]() ,水的密度为1.0g/mL,水的体积为
,水的密度为1.0g/mL,水的体积为![]() 。
。
(2)配制50g溶质质量分数为5%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解;该实验的正确操作顺序为CBDEA。
(3)步骤A为溶解操作,玻璃棒的作用是搅拌,加快氯化钠的溶解速率。
(4)①氯化钠固体不纯,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。
②称量时,砝码端忘垫质量相同的纸片,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。
③量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小。
④溶液具有均一性,装瓶时,有少量溶液洒出,溶质质量分数不变。

练习册系列答案
相关题目