��Ŀ����
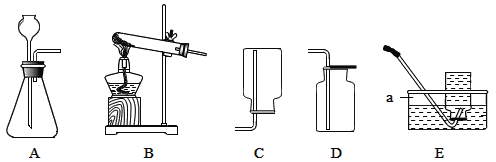
����Ŀ��ij��ѧ��ȤС���ͬѧ��ѧϰ�εĻ�ѧ����ʱ����������ʵ��:��һ������NaHCO3��Һ�м���һ������ϡHCl,��Ӧ�Ļ�ѧ����ʽ��:![]() ,����ȫ��Ӧ��(���跴Ӧ����������ȫ���ݳ�)���Է�Ӧ����Һ�����ʳɷֽ�������̽����(��ѡ�Լ���Ʒ: pH��ֽ��þƬ��ϡ���ᡢAgNO3��Һ������ͭ��ĩ��ʯ����Һ)����ɲ��룬�������������:
,����ȫ��Ӧ��(���跴Ӧ����������ȫ���ݳ�)���Է�Ӧ����Һ�����ʳɷֽ�������̽����(��ѡ�Լ���Ʒ: pH��ֽ��þƬ��ϡ���ᡢAgNO3��Һ������ͭ��ĩ��ʯ����Һ)����ɲ��룬�������������:
(���������)
����1:_____________������2: NaCl�� NaHCO3������3: NaCl�� HCl������4: NaCl�� NaHCO3��HCl��
ͬѧ�Ǿ�������һ����Ϊ���� 4��������������:_______________��
(ʵ��̽��)
ʵ����� | ʵ������ | ʵ����� |
��1��ȡ��Ӧ����Һ������ϡ���� | �����ݲ��� | ����_________������ |
��2��ȡ��Ӧ����Һ������pH��ֽ�� | ��ֽ��ɫ�� ���ձ�ɫ����pH<7 | ����3���� |
��3��ȡ��Ӧ����Һ����������ͭ��ĩ | _______________________ | ����3������д����Ӧ�Ļ�ѧ����ʽ:______________ |
��4��ȡ��Ӧ����Һ���μ�AgNO3��Һ | ������ɫ���� | ����3���� |
(�ó�����)����3��ȷ��
(�����뷴˼)��ʦ��ͬѧ�ǵ�̽�����̸����˿϶���ͬʱָ��̽���д�����һ�����ԵĴ���ԭ����___________________��
(�ܽ����)����������ʵ����Ʒ���㻹��ʲô��ͬ�ķ���ȷ�ϲ���3����ȷ�ġ���д��һ��ʵ�鷽��:___________________��
���𰸡�NaCl ̼�����ƺ�����ܹ��� 2 �����ܽ⣬��Һ����ɫ��Ϊ��ɫ CuO+2HCl=CuCl2+H2O ����1��2��3�ж������Ȼ��ƣ�������������Һ���������ɫ���� ȡ��Ӧ�����Һ���Թ��У�����þƬ�������ݲ�����֤������3��������ȡ��Ӧ�����Һ���Թ��У��μӼ�����ɫʯ����Һ����Һ���ɫ��֤������3����
��������
���������:
��һ������NaHCO3��Һ�м���һ������ϡHCl��ǡ����ȫ��Ӧʱ����Ӧ���������NaCl����NaHCO3��Һ����ʱ����Ӧ��������NaCl�� NaHCO3����HCl��Һ����ʱ����Ӧ��������NaCl�� HCl������1��NaCl������4��������ԭ���ǣ�̼�����ƺ�����ܹ��棻
ʵ��̽����
��ȡ��Ӧ����Һ������ϡ���ᣬ�����ݲ�����˵����Һ��û��NaHCO3������2��������
�ڲ���3������˵����Һ�д������ᣬ����������ͭ��Ӧ�����Ȼ�ͭ��ˮ��ȡ��Ӧ����Һ����������ͭ��ĩ�������ܽ⣬��Һ����ɫ��Ϊ��ɫ����Ӧ�Ļ�ѧ����ʽΪ�� CuO+2HCl=CuCl2+H2O��
�����뷴˼��
��ʦ��ͬѧ�ǵ�̽�����̸����˿϶���ͬʱָ��̽���д�����һ�����ԵĴ���ԭ���ǣ�����1��2��3�ж������Ȼ��ƣ�������������Һ���������ɫ������
�ܽ���ߣ�
��������þ��Ӧ������������ʹ��ɫʯ����Һ���ɫ������������ʵ����Ʒ��ȷ�ϲ���3����ȷ��ʵ�鷽���ǣ�ȡ��Ӧ�����Һ���Թ��У�����þƬ�������ݲ�����֤������3��������ȡ��Ӧ�����Һ���Թ��У��μӼ�����ɫʯ����Һ����Һ���ɫ��֤������3������

 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�