题目内容
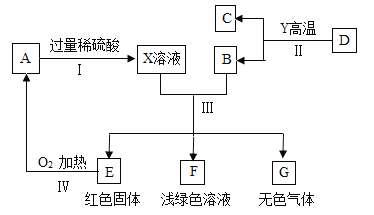
【题目】下面是制备高纯氧化锌的流程图,根据流程图回答下列问题:
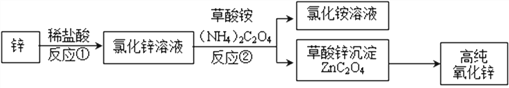
(1)反应①的基本反应类型是_________;
(2)写出反应②的化学方程式_____________________________________;
(3)过滤得到的NH4Cl溶液仍有浑浊,原因可能是____________(写出一种即可);
(4)草酸锌受热分解的化学方程式为:ZnC2O4 ![]() ZnO+CO↑+CO2↑,从环保角度看,反应后的气体,排放前的处理方法是___________________。
ZnO+CO↑+CO2↑,从环保角度看,反应后的气体,排放前的处理方法是___________________。
【答案】 置换反应 ZnCl2+(NH4)2C2O4═ZnC2O4↓+2NH4Cl 滤纸破损(或液面高于滤纸边缘) 将CO点燃
【解析】(1)根据锌与稀盐酸反应的特点分析反应的类型;(2)根据氯化锌与草酸铵的反应写出反应的化学方程式;(3)根据过滤的注意事项分析滤液浑浊的原因;(4)根据一氧化碳燃烧生成了二氧化碳分析处理尾气的方法。(1)由流程图可知,锌与稀盐酸反应生成了硫酸锌和氢气,属于一种单质与一种化合物反应生成了另一种单质和另一种化合物,属于置换反应;(2)由题意可知,氯化锌与草酸铵反应生成了氯化铵和草酸锌沉淀,反应的化学方程式为ZnCl2+(NH4)2C2O4═ZnC2O4↓+2NH4Cl;(3)过滤得到的NH4Cl溶液仍有浑浊,原因可能是滤纸破损(或液面高于滤纸边缘);(4)由于一氧化碳具有可燃性燃烧生成了二氧化碳,所以反应后的气体排放前的处理方法是将CO点燃。

【题目】某化学兴趣小组的同学在学习盐的化学性质时,做了如下实验:向一定量的NaHCO3溶液中加入一定量的稀HCl,反应的化学方程式是:![]() ,待完全反应后(假设反应产生的气体全部逸出),对反应后溶液的溶质成分进行如下探究。(限选试剂用品: pH试纸、镁片、稀盐酸、AgNO3溶液、氧化铜粉末、石蕊溶液)请完成猜想,并根据问题填空:
,待完全反应后(假设反应产生的气体全部逸出),对反应后溶液的溶质成分进行如下探究。(限选试剂用品: pH试纸、镁片、稀盐酸、AgNO3溶液、氧化铜粉末、石蕊溶液)请完成猜想,并根据问题填空:
(假设与猜想)
猜想1:_____________;猜想2: NaCl、 NaHCO3;猜想3: NaCl、 HCl;猜想4: NaCl、 NaHCO3、HCl。
同学们经过讨论一致认为猜想 4不成立,理由是:_______________。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
(1)取反应后溶液,加入稀盐酸 | 无气泡产生 | 猜想_________不成立 |
(2)取反应后溶液,滴在pH试纸上 | 试纸变色, 对照比色卡,pH<7 | 猜想3成立 |
(3)取反应后溶液,加入氧化铜粉末 | _______________________ | 猜想3成立,写出反应的化学方程式:______________ |
(4)取反应后溶液,滴加AgNO3溶液 | 产生白色沉淀 | 猜想3成立 |
(得出结论)猜想3正确。
(评价与反思)老师对同学们的探究过程给予了肯定,同时指出探究中存在着一处明显的错误,原因是___________________。
(总结提高)依据所给的实验用品,你还有什么不同的方案确认猜想3是正确的。请写出一种实验方案:___________________。