题目内容
【题目】生石灰常用作食品干燥剂,其包装袋上除了标明主要成分为生石灰外,还提醒人们注意:不可食用,不可浸水,不可开袋,儿童勿碰。
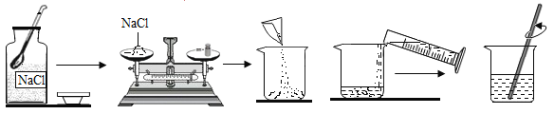
Ⅰ.小强同学通过探究发现,某食品包装袋中的生石灰干燥剂已经变质失效。他采用的探究方法是:取少量样品于试管中,加入少量水,用手触摸试管外壁,没有明显的放热现象。此实验中加入的水必须少量,理由是_____________。
Ⅱ.甲、乙同学想知道刚从食品袋中取出的生石灰干燥剂的成分,进行了如下探究:
(提出问题)生石灰干燥剂中含有哪些物质?
(查阅资料)工业上用高温煅烧石灰石的方法来制取生石灰。
(猜想与假设)猜想1:含有氧化钙、氢氧化钙
猜想2:含有氧化钙、碳酸钙
猜想3:含有氧化钙、氢氧化钙、碳酸钙
(活动与探究)甲、乙同学为了验证猜想,进行了如下实验:
甲同学实验:取少量样品于试管中,加入适量水充分反应后,再滴加几滴无色酚酞溶液,可观察到溶液呈红色。
乙同学实验:取少量样品于试管中,加入足量的稀盐酸,有无色无味的气体产生,该气体能使澄清的石灰水变浑浊。
(结论与反思)
(1)猜想_____错误(填“1”或“2”或“3”)。
(2)甲同学实验中,溶液呈红色的原因是__________。
(3)乙同学实验中产生的气体的是__________(填写化学式)。
(4)乙同学认为甲同学的实验是多余的,因为____________。
【答案】水太多时会吸收较多的热量,从而使放热现象不明显 1 氧化钙和水反应生成氢氧化钙,氢氧化钙溶液显碱性,能使无色酚酞溶液变红色 ![]() 在有氧化钙的情况下,无法检验是否含有氢氧化钙
在有氧化钙的情况下,无法检验是否含有氢氧化钙
【解析】
氧化钙和水反应生成氢氧化钙,二氧化碳和氢氧化钙反应生成碳酸钙和水,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
Ⅰ. 水太多时会吸收较多的热量,从而使放热现象不明显,故实验中加入的水必须少量。
Ⅱ. (1)加入足量的稀盐酸,有无色无味的气体产生,该气体能使澄清的石灰水变浑浊,说明是二氧化碳,进一步说明干燥剂中含有碳酸钙,故猜想1错误。
(2)氧化钙和水反应生成氢氧化钙,氢氧化钙溶液显碱性,能使无色酚酞溶液变红色,故甲同学实验中,溶液呈红色。
(3)取少量样品于试管中,加入足量的稀盐酸,有无色无味的气体产生,该气体能使澄清的石灰水变浑浊,则碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,故乙同学实验中产生的气体的是二氧化碳,化学式为![]() 。
。
(4)氧化钙和水反应生成氢氧化钙,故乙同学认为甲同学的实验是多余的,因为在有氧化钙的情况下,无法检验是否含有氢氧化钙。

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组的同学在学习盐的化学性质时,做了如下实验:向一定量的NaHCO3溶液中加入一定量的稀HCl,反应的化学方程式是:![]() ,待完全反应后(假设反应产生的气体全部逸出),对反应后溶液的溶质成分进行如下探究。(限选试剂用品: pH试纸、镁片、稀盐酸、AgNO3溶液、氧化铜粉末、石蕊溶液)请完成猜想,并根据问题填空:
,待完全反应后(假设反应产生的气体全部逸出),对反应后溶液的溶质成分进行如下探究。(限选试剂用品: pH试纸、镁片、稀盐酸、AgNO3溶液、氧化铜粉末、石蕊溶液)请完成猜想,并根据问题填空:
(假设与猜想)
猜想1:_____________;猜想2: NaCl、 NaHCO3;猜想3: NaCl、 HCl;猜想4: NaCl、 NaHCO3、HCl。
同学们经过讨论一致认为猜想 4不成立,理由是:_______________。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
(1)取反应后溶液,加入稀盐酸 | 无气泡产生 | 猜想_________不成立 |
(2)取反应后溶液,滴在pH试纸上 | 试纸变色, 对照比色卡,pH<7 | 猜想3成立 |
(3)取反应后溶液,加入氧化铜粉末 | _______________________ | 猜想3成立,写出反应的化学方程式:______________ |
(4)取反应后溶液,滴加AgNO3溶液 | 产生白色沉淀 | 猜想3成立 |
(得出结论)猜想3正确。
(评价与反思)老师对同学们的探究过程给予了肯定,同时指出探究中存在着一处明显的错误,原因是___________________。
(总结提高)依据所给的实验用品,你还有什么不同的方案确认猜想3是正确的。请写出一种实验方案:___________________。