题目内容
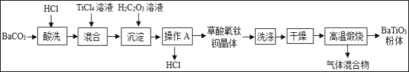
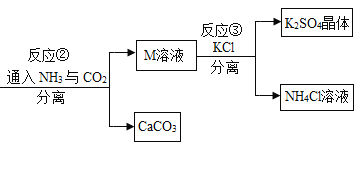
【题目】某化工厂用废硫酸制备K2SO4的流程如下:

物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20°C) | 34.2 | 11.1 | 37.2 | 75.4 |
(1)生产上将CaCO3研成粉末的目的是________________________________。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是______(填化学式)。
(3)写出反应②的化学方程式:___。
(4)反应③中相关物质的溶解度如表所示。反应③在常温下能实现的原因是____。
(5)洗涤反应③所得晶体不用水而用饱和K2SO4溶液的目的是_______;检验此晶体是否洗净的方法是_____。
【答案】增大接触面积,加快反应速率 CaCO3 ![]() 常温下K2SO4的溶解度小 减少K2SO4的溶解 取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,取上层清液,滴加AgNO3溶液,如果没有白色沉淀产生,说明洗涤干净
常温下K2SO4的溶解度小 减少K2SO4的溶解 取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,取上层清液,滴加AgNO3溶液,如果没有白色沉淀产生,说明洗涤干净
【解析】
(1)由于反应物之间接触越充分,反应越快,转化率也越高,所以生产上将CaCO3研成粉末的目的是 增大接触面积,加快反应速率,转化率提高;
(2)在上述过程中二氧化碳和碳酸钙开始是反应物后来是生成物,所以上述流程中,除可综合利用CO2外,还可循环使用的物质是 CaCO3;
(3)反应②是硫酸钙和氨气、二氧化碳和水反应生成硫酸铵和碳酸钙,对应的化学方程式:CaSO4+2NH3+CO2+H2O═(NH4)2SO4+CaCO3↓;
(4)反应③在常温下能实现的原因是 常温下K2SO4的溶解度小;
(5)洗涤反应③所得晶体不用水而用饱和K2SO4溶液的目的是减少K2SO4的溶解;检验此晶体是否洗净也就是确认是否有附着的氯化铵,所以对应的操作:取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,取上层清液,滴加AgNO3溶液,如果没有白色沉淀产生,说明洗涤干净。