题目内容
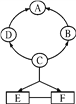
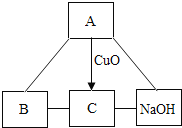
【题目】以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图。如图为铁的价类图,例如E点可表示为+2价的亚铁盐,请回答:
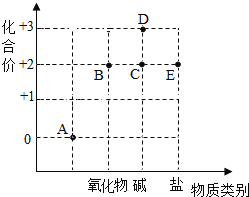
(1)A点表示的物质所属的物质类别是_______;
(2)已知C点表示的化合物在常温下能与氧气、水发生化合反应生成D,写出相应的化学方程式____;
(3)请写出E点表示的硝酸盐化学式_____。
【答案】单质 ![]() Fe(NO3)2
Fe(NO3)2
【解析】
(1)单质化合价为零,由图示可知A点物质的化合价是零,所以物质类别是单质;
(2)由于C点是铁的+2价的碱,属于氢氧化亚铁,D是+3价铁的碱,即氢氧化铁,由题给信息可知,反应物是氢氧化亚铁、氧气和水,生成物是氢氧化铁,用观察法配平,所以方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)E点可表示为+2价的硝酸亚铁盐,化学式为:Fe(NO3)2。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】如图是某食盐包装上的部分说明。食盐中加入碘酸钾的目的是补充微量元素___。

(提出问题)为什么在汤、菜即将煮好时再加入碘盐,确保碘效?
(查阅资料)碘酸钾的化学式KIO3,是一种白色粉末,熔点560℃。采用热重分析仪对碘酸钾加热过程展开研究,混合物中碘酸钾的质量分数(纵坐标)随温度(横坐标)变化的曲线如图所示。
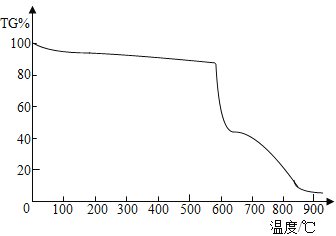
(猜想假设1)KIO3和性质KClO3性质相似,受热分解产生O2。
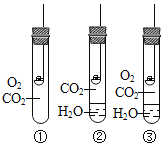
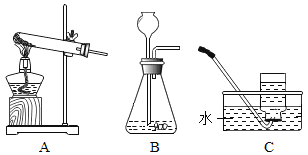
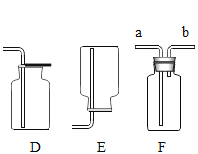
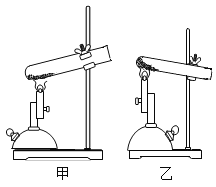
(实验探究1)研究小组进行如图所示实验,宜选用装置____(填序号)进行。验证KIO3分解产生氧气的操作和现象为_____。
(得出结论1)KIO3受热同时生成碘化钾(KI),化学方程式为____。
(提出新问题)为什么生成KI就会降低碘效?
(查阅资料2)KIO3在人体内转化为I-而被吸收。KI是白色固体,在空气中与O2、CO2、H2O中的两种或三种物质反应生成单质I2而泛黄变质。
(实验探究2)研究小组开展以下实验
操作 | 现象 | 结论 |
如下图所示,在燃烧匙中放入KI固体,然后分别放置在①②③号试管中,数日后观察现象
| _______ | KI固体在空气中与O2、CO2、H2O共同作用而变质,导致碘效降低 |
(反思提高)
(1)讨论后大家认为以上实验方案有所欠缺。甲同学补充实验:_______。
(2)乙同学推测另一种产物是碳酸盐,请用实验加以证明:______,证明推测正确。
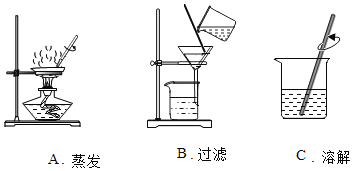
(拓展应用)生活中鉴别真假加碘盐的方法是:取少量碘盐样品在干净的锅里高温爆炒2min,再加入部分未爆炒过的碘盐在碗中混合,加少量白醋,再把刚切好的土豆片浸泡其中,20min后若溶液变蓝,则是加碘盐。下列说法不正确的是____(填字母)。
A 实验中土豆片不可用其他食品代替
B 直接将加碘盐放在土豆片上不能呈蓝色
C 可能是酸性条件下KIO3和KI能反应生成I2
D 烹饪时加醋可能增大食盐中的碘流失
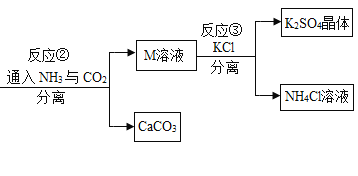
【题目】某化工厂用废硫酸制备K2SO4的流程如下:

物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20°C) | 34.2 | 11.1 | 37.2 | 75.4 |
(1)生产上将CaCO3研成粉末的目的是________________________________。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是______(填化学式)。
(3)写出反应②的化学方程式:___。
(4)反应③中相关物质的溶解度如表所示。反应③在常温下能实现的原因是____。
(5)洗涤反应③所得晶体不用水而用饱和K2SO4溶液的目的是_______;检验此晶体是否洗净的方法是_____。
【题目】下表是氯化铵固体在不同温度下的溶解度
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 | 65.6 |
①向100 g水中不断加入氯化铵固体或改变温度,得到下图相应的溶液A~E。
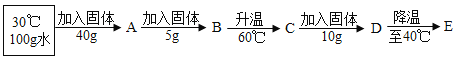
溶液D是_____ (填“ 饱和”或“不饱和”)溶液,溶液E中析出晶体__g。
②将盛有溶液E的小烧杯放入盛有水的大烧杯中,向大烧杯内加入NaOH固体,小烧杯内的固体溶解,原因是______。