题目内容
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2.4H2O],煅烧可获得钛酸钡粉体。
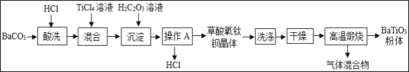
(1)BaTiO3中Ti元素的化合价是_____。
(2)“酸浸”过程中发生反应的化学方程式为_____。
(3)“操作A”的名称是_____。
(4)“绿色化学”理念提倡循环利用,流程中能循环使用的物质是_____。
(5)现有394kg BaCO3,理论上可以制备BaTiO3的质量为_____kg.( BaTiO3的相对分子质量为233,BaCO3的相对分子质量为197)
【答案】+4 BaCO3+2HCl=BaCl2+H2O+CO2↑ 蒸发结晶 HCl 233
【解析】
(1)钡元素的化合价为+2价,氧元素的化合价为-2价,设Ti的化合价为x,根据化合物中各元素的化合价的代数和为零,则+2+x+(-2)×3=0,x=+4,故填+4。
(2)“酸浸”过程中碳酸钡与盐酸反应生成氯化钡、水和二氧化碳,故反应的化学方程式写为:BaCO3+2HCl=BaCl2+H2O+CO2↑。
(3)利用“操作A”将草酸氧钛钡晶体和盐酸进行了分离,该操作应为蒸发结晶,故填蒸发结晶。
(4)由流程图可知,流程中能循环使用的物质是HCl,故填HCl。
(5)解:设可以制备 BaTiO3的质量为x
394kg×![]() x×
x×![]() ×100%
×100%
x=233kg
答:以制备 BaTiO3的质量为233kg。

练习册系列答案
相关题目
【题目】下列实验方案不能达到实验目的是( )
序号 | A | B | C | D |
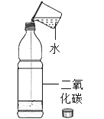
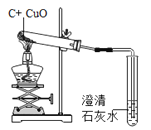
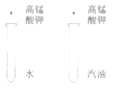
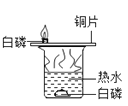
目的 | 证明二氧化碳溶于水且能和水反应 | 证明碳与氧化铜能发生反应 | 探究同种溶质在不同的溶剂的溶解性 | 探究燃烧的条件是燃烧需要氧气 |
方案 |
|
|
|
|
A. AB. BC. CD. D