题目内容
【题目】对久置于空气中的“生石灰”干燥剂的组成成分及含量进行探究
(查阅资料)Ca(OH)2加热到一定温度时会发生分解反应,生成两种氧化物。
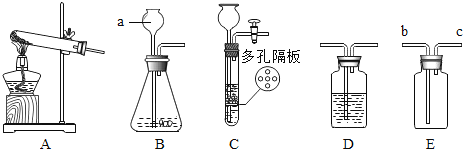
(实验探究)该小组称取15.2g干燥剂样品于控温电加热器中,按如图所示装置进行实验(装置气密性良好,A、B、C中药品足量,实验操作正确)
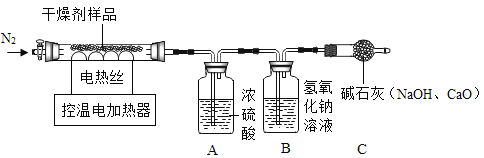
(数据记录)充分反应后,产物被完全吸收,A装置增重1.8g,B装置增重2.2g。
(分析结论)该包干燥剂的成分是_____(填化学式),
(数据处理)该15.2g干燥剂样品,若加入过量稀盐酸后,蒸发至干,得到氯化钙固体质量是_____g。
(反思拓展)①停止加热后,需要通入N2一段时间的目的是_____。
②若没有C装置,会导致含量测定结果偏小的成分是_____。
【答案】CaO、Ca(OH)2、CaCO3 22.2g 使反应生成的水、二氧化碳全部被浓硫酸、氢氧化钠溶液吸收 CaO
【解析】
生石灰久置于空气中,氧化钙能与空气中的水蒸气反应生成氢氧化钙,氢氧化钙能与空气中的二氧化碳反应生成碳酸钙,将干燥剂样品于控温电加热器中,充分反应后,产物被完全吸收,A装置增重1.8g,B装置增重2.2g,浓硫酸具有吸水性,A装置增重,说明干燥剂中含有氢氧化钙,Ca(OH)2加热到一定温度时会发生分解反应,生成氧化钙和水,B装置增重,说明生成了二氧化碳,说明干燥剂中含有碳酸钙,碳酸钙在加热的条件下分解生成了氧化钙和二氧化碳。
设该干燥剂样品中,氢氧化钙的质量为x
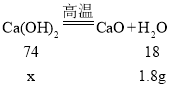
![]() x=7.4g
x=7.4g
设该干燥剂样品中,碳酸钙的质量为y
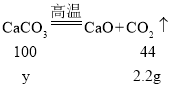
![]() y=5g
y=5g
故该干燥剂样品中还含有氧化钙,氧化钙的质量为:15.2g-7.4g-5g=2.8g,
故该包干燥剂的成分是:CaCO3、CaO、Ca(OH)2;
数据处理:向该干燥剂样品中加入过量稀盐酸,发生以下化学方程式:
![]()
![]() ,
,![]() ,由化学方程式可知,该干燥剂中的钙元素都转化到了氯化钙中。
,由化学方程式可知,该干燥剂中的钙元素都转化到了氯化钙中。
碳酸钙中钙元素的质量:
![]() ;
;
氧化钙中钙元素的质量:![]() ;
;
氢氧化钙中钙元素的质量:
![]() ;
;
得到氯化钙固体的质量为:
![]()
反思拓展:①停止加热后,需要通入N2一段时间的目的是:使反应生成的水、二氧化碳全部被浓硫酸、氢氧化钠溶液吸收;
②若没有C装置,空气中的二氧化碳会被氢氧化钠吸收,导致测定的二氧化碳质量偏大,从而碳酸钙的测定结果偏大,由于浓硫酸中吸收的水分含量不变,故氢氧化钙的测定值不变,从而导致氧化钙的测定结果偏小。