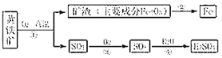
题目内容
【题目】将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如图所示:
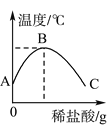
(1)由图可知,稀盐酸与氢氧化钠溶液发生的反应是________(填“放热”或“吸热”)反应。
(2)从A到B过程中,烧杯中溶液的pH逐渐________。
(3)______点时恰好完全反应,C点的溶液中含有的溶质为________。
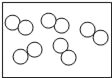
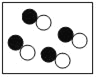
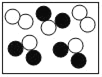
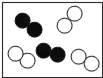
(4)如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,
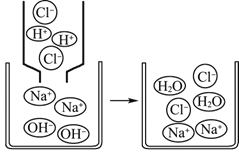
由此得出该反应的实质是____。写出另一个符合该反应实质的化学方程式______。
【答案】放热 减小 B 氯化钠还有氯化氢 H+和OH-结合生成H2O分子 HCl+KOH==KCl+H2O
【解析】
(1)①由图象可以看出,随着稀盐酸的加入,温度在逐渐的升高,说明稀盐酸与氢氧化钠溶液发生的反应是放热反应;
(2)由图示可知,从A到B过程中,稀盐酸的量逐渐增加,则氢氧化钠逐渐减少,碱性减弱,故pH值逐渐减小;
(3)在B点前后温度是两种情况,B点温度最高,B点表示酸碱恰好完全反应,反应后生成氯化钠和水,显中性,溶液中的pH=7;B到C的溶液中,是盐酸中和完氢氧化钠后继续加入盐酸,盐酸过量,故溶液中的溶质既有氯化钠还有氯化氢;
(4)由氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,对比反应前后微粒的变化可知,中和反应的实质是:H+和OH-结合生成H2O分子。符合该反应实质的化学方程式HCl+KOH=KCl+H2O(合理即可)。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的的是( )
编号 | A | B |
实验设计 |
|
|
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 探究氧气是燃烧的条件之一 |
编号 | C | D |
实验设计 |
|
|
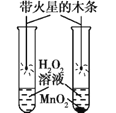
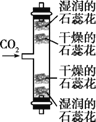
实验目的 | 探究二氧化锰的催化作用 | 探究CO2的密度和石蕊花变红的原因 |
A. AB. BC. CD. D
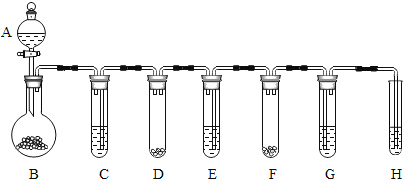
【题目】某化学兴趣小组在一次实验中进行如图所示的实验:
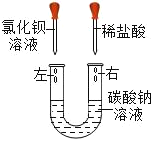
此时观察到U形管左右两侧产生的现象是不同的;实验后,小组同学充分振荡U形管。发现管内仍有白色固体残留。将固体分离后,同学们对滤液成分产生浓厚的兴趣,于是进行了进一步的探究活动
(1)(提出问题)滤液中可能含有哪些溶质?
(猜想与假设)猜想一:溶质为NaCl
猜想二:溶质为NaCl和BaCl2
猜想三:溶质为NaCl、BaCl2和HCl
你认为以上猜想_____不合理;理由是_____(请用化学方程式表示);请写出你的猜想_____。
(2)(实验探究)小红为了验证滤液成分,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此得出结论:猜想一成立。小刚认为小红的结论是否严密_____(填“严密”或“不严”)。
为了验证你的猜想,请填写下表:
实验操作 | 实验现象 | 实验结论 |
取滤液适量于试管中,向其中滴加适量_____溶液 | 溶液由无色变为红色 | 你的猜想成立 |
(3)(归纳与总结)通过上述实验,我们能够总结出:在确定化学反应后所得溶液溶质成分时,除了考虑生成物外,还需要考虑_____。