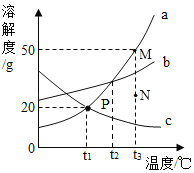
题目内容
【题目】工业产品过氧化钙晶体(CaO2·8H2O)较稳定,呈白色,微溶于水,广泛用于环境杀菌、消毒。以贝壳(主要成分是 CaCO3,杂质不参加反应也不溶于水)为原料制备 CaO2的流程如下:
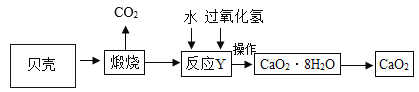
(1)CaO2中氧元素的化合价为___________;
(2)上述流程中将过氧化钙晶体从溶液中分离的步骤是过滤,该操作中用到的玻璃仪器有玻璃棒、 烧杯和_______________,其中玻璃棒的作用是_______________;
(3)反应 Y 需要在低温条件下进行,其原因是_________________;
(4)获取的 CaO2 中常含有 Ca(OH)2 杂质,原因是_______________(用化学方程式表示)。
【答案】-1 漏斗 引流 高温时,CaO2·8H2O易分解 CaO+H2O=Ca(OH)2
【解析】
(1)过氧化钙(CaO2)中钙元素的化合价为+2,设:氧元素的化合价为x,根据化合物中各元素的化合价代数和为零,则有(+2)+2x=0,x=-1;
(2)上述流程中将过氧化钙晶体从溶液中分离的步骤是过滤,该操作中用到的玻璃仪器有玻璃棒、 烧杯和漏斗,其中玻璃棒的作用是引流;
(3)反应 Y 需要在低温条件下进行,其原因是高温时,CaO2·8H2O易分解;
(4)获取的 CaO2 中常含有 Ca(OH)2 杂质,氧化钙与反应生成氢氧化钙,反应的化学方程式为:CaO+H2O=Ca(OH)2。

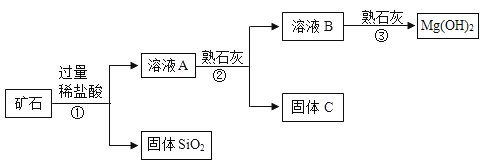
【题目】某矿石主要成分是 MgO,含少量的 Fe2O3、CuO 和 SiO2 杂质。用该矿石制备 Mg(OH)2 的工艺流程简图如下, 回答下列问题:
对应离子 | Fe3+ | Cu2+ | Mg2+ |
开始沉淀时的 pH | 1.9 | 4.2 | 9.1 |
完全沉淀时的 pH | 3.2 | 6.7 | 11.1 |
(1)步骤①和步骤②均用到的操作是_____;
(2)溶液 A 中所含的阳离子有 Fe3+、Cu2+、Mg2+和_____(填离子符号);
(3)已知部分金属阳离子以氢氧化物形式形成沉淀时溶液的 pH 如上表所示,则步骤②中加入熟石灰,调节溶液的 pH 范围为_____。