题目内容
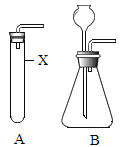
【题目】在氢氧化钠溶液中加入 X 溶液并插入温度计,逐滴加入硫酸溶液,观察到红色褪去,温度计示数上升。证明碱与酸能发生反应,且放出热量。
(1)加入的 X 溶液应该是_____溶液;
(2)甲同学提出滴入的硫酸不能用浓硫酸,他的理由是_____;
(3)乙同学提出红色褪去不能说明酸和碱恰好反应完全,为了证明是否恰好反应,可取上述反应后的无色溶液少许加入_____即可(填序号)。
①铜 ②镁 ③氧化铜 ④BaCl2 溶液 ⑤Na2CO3 溶液
(4)若取10%的氢氧化钠溶液100g和10%的硫酸溶液100g混合后,加入紫色石蕊,则此时溶液呈_____色(填序号)。
①紫 ②红 ③蓝
【答案】无色酚酞 浓硫酸溶于水放出大量的热 ②③⑤ ③
【解析】
(1)在氢氧化钠溶液中加入X溶液并插入温度计,逐渐滴加硫酸溶液,观察到红色褪去。无色酚酞溶液遇碱性溶液变红色,则加入的X溶液应该是无色酚酞溶液。故答案为:无色酚酞;
(2)浓硫酸溶于水会放出大量的热,不能确定产生的热量是浓硫酸稀释形成的,还是酸碱中和反应形成的。故答案为:浓硫酸溶于水放出大量的热;
(3)溶液中红色褪去能证明溶液不呈碱性,可能是酸性或中性。溶液呈酸性时,溶质是硫酸钠和硫酸。溶液呈中性时,溶质是硫酸钠。
①铜:铜不和硫酸反应,加入后,无明显现象,无法区分。①错误;
②镁:镁和硫酸反应生成氢气,能观察到溶液中有气泡产生。有气泡产生,则为酸过量,若没有气泡产生,则恰好完全反应。②正确;
③氧化铜:氧化铜和硫酸反应生成硫酸铜和水,能观察到氧化铜逐渐溶解,溶液由无色变为蓝色。有明显现象,则为酸过量,若无明显现象,则恰好完全反应。③正确;
④氯化钡溶液:氯化钡溶液和硫酸钠反应生成硫酸钡沉淀和氯化钠。氯化钡溶液和硫酸反应生成硫酸钡沉淀和盐酸。无论是酸过量还是恰好完全反应,始终都能观察到有白色沉淀产生,无法正确判断。④错误;
⑤碳酸钠溶液:碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,能观察到溶液中有气泡产生。有气泡产生,则为酸过量,若没有气泡产生,则恰好完全反应。⑤正确。
故答案为:②③⑤;
(4)100g、10%的氢氧化钠溶液硫酸溶液的溶质质量为:100g×10%=10g。根据化学反应方程式可知,消耗的硫酸与氢氧化钠的质量比关系如下:
![]()
由此可知,98份质量的硫酸与80份质量的氢氧化钠恰好完全反应。则100g、10%的氢氧化钠溶液和硫酸溶液混合后,氢氧化钠有剩余,则溶液呈碱性。紫色石蕊试液遇碱性溶液变蓝。故答案为:③。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案