题目内容
【题目】烧杯盛有一定质量的氢氧化钠和氢氧化钾的固体混合物,向其中加入100 g质量分数为7.3%的稀盐酸,恰好完全反应,得到109.6 g该温度下的不饱和溶液。则原固体混合物中金属元素的质量分数与下列数据最接近的是
A. 57.5% B. 64.6% C. 67.7% D. 69.6%
【答案】B
【解析】根据氢氧化钠和氢氧化钾与盐酸反应的化学方程式:NaOH+HCl![]() NaCl+H2O、KOH+HCl
NaCl+H2O、KOH+HCl![]() KCl+H2O以及质量守恒定律,可知氢氧化钠和氢氧化钾混合物的质量为109.6 g﹣100 g=9.6 g。根据酸碱中和反应的实质是OH-+H+
KCl+H2O以及质量守恒定律,可知氢氧化钠和氢氧化钾混合物的质量为109.6 g﹣100 g=9.6 g。根据酸碱中和反应的实质是OH-+H+![]() H2O,且氢氧化钠、氢氧化钾电离出的阴离子全是OH-,阳离子均为金属离子,求出氢氧根离子的质量,既能求出金属元素的质量。反应的氯化氢质量为100 g×7.3% =7.3 g,设反应中消耗氢氧根离子的质量为x。
H2O,且氢氧化钠、氢氧化钾电离出的阴离子全是OH-,阳离子均为金属离子,求出氢氧根离子的质量,既能求出金属元素的质量。反应的氯化氢质量为100 g×7.3% =7.3 g,设反应中消耗氢氧根离子的质量为x。
OH-~HCl~H2O
17 36.5
x 7.3 g
x=3.4 g
故钠元素和钾元素质量和为:9.6 g﹣3.4 g=6.2 g。则原固体混合物中金属元素的质量分数为![]() ×100%≈64.6%,故选B。
×100%≈64.6%,故选B。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
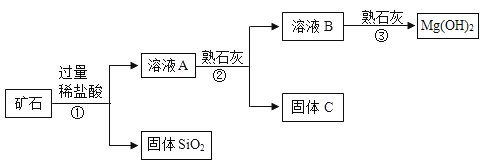
【题目】某矿石主要成分是 MgO,含少量的 Fe2O3、CuO 和 SiO2 杂质。用该矿石制备 Mg(OH)2 的工艺流程简图如下, 回答下列问题:
对应离子 | Fe3+ | Cu2+ | Mg2+ |
开始沉淀时的 pH | 1.9 | 4.2 | 9.1 |
完全沉淀时的 pH | 3.2 | 6.7 | 11.1 |
(1)步骤①和步骤②均用到的操作是_____;
(2)溶液 A 中所含的阳离子有 Fe3+、Cu2+、Mg2+和_____(填离子符号);
(3)已知部分金属阳离子以氢氧化物形式形成沉淀时溶液的 pH 如上表所示,则步骤②中加入熟石灰,调节溶液的 pH 范围为_____。