题目内容
【题目】向氢氧化钠溶液中滴入酚酞试液,可以看到溶液变______色,再向溶液中逐滴滴入稀盐酸,当观察到溶液变______色时,表明反应已经完成。反应的化学方程式是_____________,此时反应物的物质的量之比为_______,该反应属于______________反应。
【答案】红 无 ![]() 1:1 中和/复分解
1:1 中和/复分解
【解析】
氢氧化钠显碱性,能使酚酞试液变红,故可以看到溶液变红色;
再向溶液中逐滴滴入稀盐酸,氢氧化钠与稀盐酸反应生成氯化钠和水,氯化钠显中性,故当观察到溶液变无色时,表示反应已经完成;
该反应的化学方程式为:![]() ;
;
此时反应物的物质的量之比为:1:1;
该反应是酸和碱反应生成盐和水的中和反应,且该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,还属于复分解反应。

【题目】如图“黑面包”实验中,蔗糖(C12H22O11)变黑,体积膨胀,变成疏松的炭,放出有刺激性气味的气体。
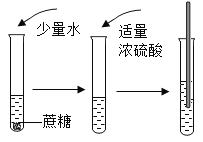
(提出问题)改变糖的种类、浓硫酸的体积、水的滴数和温度是否会影响实验效果呢?
(进行实验)分别取5g糖粉进行实验,根据前2 min的现象对实验效果进行评分,记录如下:
表1 实验记录
实验 | 糖 | 浓硫酸体积/mL | 水的滴数 | 温度/℃ | 效果得分 |
1 | 蔗糖 | 4 | 5 | 22 | 65 |
2 | 蔗糖 | 5 | 10 | 30 | 81 |
3 | 蔗糖 | 6 | 15 | 50 | 93 |
4 | 冰糖 | 4 | 10 | 50 | 91 |
5 | 冰糖 | 5 | 15 | 22 | 88 |
6 | 冰糖 | a | 5 | 30 | 75 |
7 | 葡萄糖 | 4 | 15 | 30 | 0 |
8 | 葡萄糖 | 5 | 5 | 50 | 0 |
9 | 葡萄糖 | 6 | 10 | 22 | 0 |
(处理数据)分析表1,计算效果得分均值,结果如下:
表2 效果得分均值
因素 | 糖 | 浓硫酸体积/mL | 水的滴数 | 温度/℃ | ||||||||
蔗糖 | 冰糖 | 葡萄糖 | 4 | 5 | 6 | 5 | 10 | 15 | 22 | 30 | 50 | |
均值 | 79.7 | 84.7 | 0 | 52.0 | 56.3 | 56.0 | 46.7 | 57.3 | 60.3 | 51.0 | 52.0 | 61.3 |
依据均值推断最佳实验方案,均值越高,效果越好。
(解释与结论)
(1)推测放出的气体含SO2,从元素守恒角度说明理由_____;
(2)实验6中,a为_____mL;
(3)根据表2推断,“黑面包”实验最好选择5 g冰糖、5 mL浓硫酸、_____滴水和50 ℃;
(反思与评价)
(4)表2中,22 ℃对应的均值为51.0,计算该值所依据的3个数据分别是_____;
(5)综合分析,使实验3的效果得分高于实验4的因素有_____。
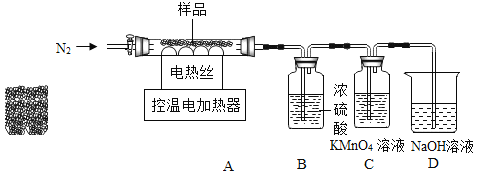
【题目】实验室制取气体常用装置如下图所示,请回答以下问题:
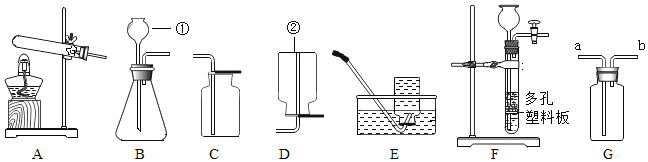
(1)请写出图中标号仪器的名称:①______________;②_________________。
(2)实验室用A装置制取氧气的化学方程式是______________,收集较纯净的氧气选用的装置是_______________(填字母)。
(3)实验室制取二氧化碳选择装置F和G组合,与B装置相比,选用F作为发生装置的主要优点是______________;如用G装置收集二氧化碳时,检验气体收集满的方法是______________。如用G装置检验二氧化碳,先在瓶内加入适量的澄清石灰水,二氧化碳应从__________端(选填 “a”或 “b”)通入。
(4)为了测定实验室制取二氧化碳所用的石灰石中碳酸钙的含量,某兴趣小组的同学称取50g石灰石样品。分别在5只烧杯中进行了实验,实验数据见下表(假设样品中除碳酸钙外,其余成分不与盐酸反应。):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成气体的质量/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
①表中X的值为_________;
②样品中碳酸钙的质量分数为__________。