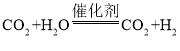题目内容
【题目】以柴油为燃料的汽车加装尿素箱可使尾气排放达“国四”标准。其工作原理是:
(1)将尿素溶液均匀喷入热的尾气中,并释放出氨气,其反应方程式为: CO(NH2)2 + X = CO2 + 2NH3 ,则X的化学式为___________。
(2)在催化剂的作用下,氨气使尾气中的氮氧化物快速转化成无害的氮气和水蒸气,水蒸气可吸收尾气中的烟尘,减少PM2.5排放。请写出氨气和N2O反应的化学方程式:________
(3)尿素在农业上用作______肥,_______(填:“能”、“不能”)与熟石灰混合使用。
【答案】H2O 2NH3 + 3N2O 4N2 +3H2O 氮(N) 能
4N2 +3H2O 氮(N) 能
【解析】
(1)根据反应前后元素种类不变,原子个数不变,则:反应前除X外,有碳原子1个、氧原子1个、氮原子2个、氢原子4个;反应后的碳原子1个、氮原子2个、氧原子2个、氢原子6个,因此X中有氧原子1个、氢原子2个,故X的化学式是H2O;
(2)氨气和N2O在催化剂的作用下反应生成水蒸气和氮气,反应的化学方程式为:2NH3 + 3N2O 4N2 +3H2O;
4N2 +3H2O;
(3)尿素属于氮肥,不是铵态氮肥,能与熟石灰混合使用。

【题目】某化学兴趣小组进行以下实验:在室温为 15℃时,同学们将 10g 氢氧化钠固体完全溶解于 80g 水中,冷却至室温后匀速的通入二氧化碳气体。同时用传感器测定溶液的 pH 及温度的变化,用数据采集器记录并绘制图像如图 2 和图 3 所示。
(查阅资料)
①碳酸氢钠和碳酸钠的溶解度表(一个标准大气压下)(部分)
温度/℃ | 0 | 15 | 20 | 30 |
碳酸氢钠的溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 |
碳酸钠的溶解度/g | 7.1 | 13.25 | 21.8 | 39.7 |
②向碳酸钠溶液中通入二氧化碳能化合生成碳酸氢钠。
(进行实验)

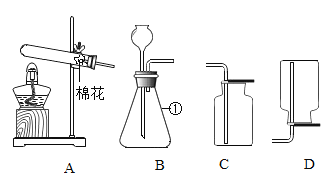
(1)图 1 所示实验中,用“分液漏斗”而不用“长颈漏斗”的原因是_____;
(2)通过图像分析,小苏打溶液是显_____(填“酸性”、“中性”或“碱性”)。
(3)为了确定M 处溶液的成分,同学们进行了如下实验:
实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
① | 加入过量的_____; | 产生白色沉淀 | 含有_____。 |
② | 滴入_____; | 溶液变红 |
(反思与评价)
(4)为确定 M 处溶液的成分,(3)中步骤①中加过量试剂的目的是_____,步骤①②能否颠倒?_____(填“能”或“否”)。/p>
(注意:若答对第(5)、(6)小题奖励 4 分,化学试卷总分不超过 60 分。)

(拓展延伸)
(5)实验过程中,同学们发现 18min 后溶液的 pH 不再变化, 则此时烧杯中就可能观察到的现象有_____。
(6)图 2 中,BC 段发生反应的化学方程式为_____。图 3 中,DE 段温度变化的原因_____。
【题目】为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取混合物10g,放入一干净的烧杯中,然后取一定溶质质量分数的稀硫酸100g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 0.12 | x | 0.36 | 0.4 | y |
(1)上表中x=_______、y=_______.
(2)固体混合物中镁元素的质量分数为__________.