题目内容
【题目】物质 X 在 4.8g 氧气中恰好完全燃烧,反应方程式为 X+3O2![]() RO2+2SO2,测得RO2 和 SO2 的质量分别为 2.2g 和 6.4g,下列判断中正确的是( )
RO2+2SO2,测得RO2 和 SO2 的质量分别为 2.2g 和 6.4g,下列判断中正确的是( )
A.X 的相对分子质量为 76B.参加反应的 X 的质量为 3.9g
C.X 中含有 R 元素、S 元素和 O 元素D.产物为气态时都是空气污染物
【答案】A
【解析】
依据方程式X+3O2![]() RO2+2SO2可知,反应前后氧原子的个数相等,反应后生成物中有R原子和硫原子,则反应物X一定有R原子和硫原子,一定没有氧原子。已知SO2 的质量为6.4g,则硫元素的质量为
RO2+2SO2可知,反应前后氧原子的个数相等,反应后生成物中有R原子和硫原子,则反应物X一定有R原子和硫原子,一定没有氧原子。已知SO2 的质量为6.4g,则硫元素的质量为![]() ,根据质量守恒定律,反应物X参加反应的质量为
,根据质量守恒定律,反应物X参加反应的质量为![]() ,已知X由R元素和硫元素组成,则R元素的质量为
,已知X由R元素和硫元素组成,则R元素的质量为![]() 。依据RO2的质量为 2.2g,设R的相对原子质量为M,则RO2中R元素与氧元素的质量比为
。依据RO2的质量为 2.2g,设R的相对原子质量为M,则RO2中R元素与氧元素的质量比为![]() 解得M=12,所以R为碳元素,RO2为二氧化碳。设X的化学式为
解得M=12,所以R为碳元素,RO2为二氧化碳。设X的化学式为![]() ,化学式为
,化学式为![]() 中两种元素的质量比为
中两种元素的质量比为![]() ,解得
,解得![]() ,则X的化学式为
,则X的化学式为![]() 。
。
A、X的相对分子质量为![]() ,A正确;
,A正确;
B、参加反应的 X 的质量为![]() ,B不正确;
,B不正确;
C、X 中一定含有R元素、S元素,一定不含O元素,C不正确;
D、产物为气态时有二氧化碳和二氧化硫,二氧化硫是空气污染物,二氧化碳不属于空气污染物,D不正确。故选A。

练习册系列答案
相关题目
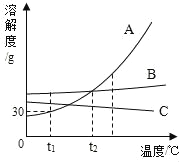
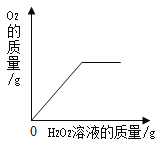
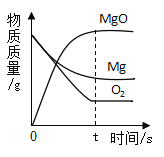
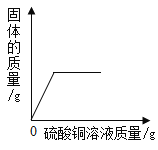
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
A.向一定质量的二氧化 锰中加入过氧化氢溶液 | B. 向等 质量的镁 粉和 铝粉中分别加入等浓度 的稀盐酸 | C. 镁在氧气中燃烧 | D. 向一定量铁粉和铜粉混 合物中加入硫酸铜溶液 |
A.AB.BC.CD.D