题目内容
【题目】某碳酸钠样品含有少量的硫酸钠,取12g的该样品,完全溶解在水中配制成100g溶液,将其全部加入到100g一定质量分数的硫酸溶液中,恰好完全反应,生成的气体全部逸出后,所得溶液质量是195.6g。计算:
(1)加入的硫酸溶液的溶质质量分数_________;
(2)将反应后滤液蒸干,可得固体多少克_________?
【答案】9.8% 15.6g
【解析】
(1)根据质量守恒定律可知,生成CO2的质量:100g+100g-195.6g=4.4g;
设加入的硫酸中溶质的质量为x,生成的硫酸钠的质量为y,原样品中碳酸钠的质量为z 。

![]() ,x=9.8g,
,x=9.8g,
![]() ,y=14.2g,
,y=14.2g,
![]() ,z=10.6g
,z=10.6g
加入的硫酸溶液的溶质质量分数=![]() ;
;
(2)将反应后滤液蒸干,可得固体质量=14.2g+12g-10.6g=15.6g。
答:(1)加入的硫酸溶液的溶质质量分数为9.8%;
(2)将反应后滤液蒸干,可得国体质量为15.6g。

【题目】下图是实验室常见的发生装置,请回答有关问题:
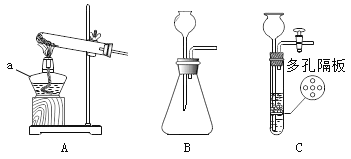
(1)写出图中仪器的名称:a _____。
(2)实验室用大理石和稀盐酸制取二氧化碳,反应的化学万程式是_____;可用B、C作发生装置,C与B相比的主要优点是_____。
(3)某小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
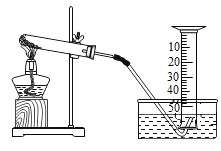
编号 | KClO3质量 (g) | 催化剂种类 | 催化剂质量(g) | 收集50mLO2所需时间(s) |
实验1 | 5 | 170 | ||
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 60 |
实验4 | 5 | KCl | 0.5 | 152 |
Ⅰ设置实验1的目的是_____。
Ⅱ表中催化剂的催化效果最佳的是_____(填化学式)。
Ⅲ由实验1和实验4可知,KCl_____(填“有”或“无”)催化作用。维持加热条件不变,用实验1继续收集50mLO2,所需时间明显少于170s。解释原因:_____。
Ⅳ要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量_____。