题目内容
【题目】某化学兴趣小组进行以下实验:在室温为 15℃时,同学们将 10g 氢氧化钠固体完全溶解于 80g 水中,冷却至室温后匀速的通入二氧化碳气体。同时用传感器测定溶液的 pH 及温度的变化,用数据采集器记录并绘制图像如图 2 和图 3 所示。
(查阅资料)
①碳酸氢钠和碳酸钠的溶解度表(一个标准大气压下)(部分)
温度/℃ | 0 | 15 | 20 | 30 |
碳酸氢钠的溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 |
碳酸钠的溶解度/g | 7.1 | 13.25 | 21.8 | 39.7 |
②向碳酸钠溶液中通入二氧化碳能化合生成碳酸氢钠。
(进行实验)

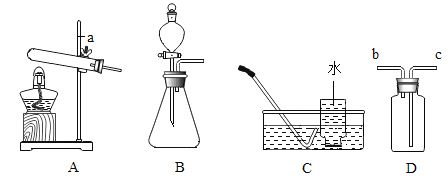
(1)图 1 所示实验中,用“分液漏斗”而不用“长颈漏斗”的原因是_____;
(2)通过图像分析,小苏打溶液是显_____(填“酸性”、“中性”或“碱性”)。
(3)为了确定M 处溶液的成分,同学们进行了如下实验:
实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
① | 加入过量的_____; | 产生白色沉淀 | 含有_____。 |
② | 滴入_____; | 溶液变红 |
(反思与评价)
(4)为确定 M 处溶液的成分,(3)中步骤①中加过量试剂的目的是_____,步骤①②能否颠倒?_____(填“能”或“否”)。/p>
(注意:若答对第(5)、(6)小题奖励 4 分,化学试卷总分不超过 60 分。)

(拓展延伸)
(5)实验过程中,同学们发现 18min 后溶液的 pH 不再变化, 则此时烧杯中就可能观察到的现象有_____。
(6)图 2 中,BC 段发生反应的化学方程式为_____。图 3 中,DE 段温度变化的原因_____。
【答案】便于控制生成二氧化碳的速率 碱性 氯化钙溶液 碳酸钠、氢氧化钠 酚酞试液 碳酸钠完全反应,避免对氢氧化钠检验产生干扰 能 析出固体 Na2CO3+CO2+H2O=2NaHCO3 氢氧化钠和二氧化碳反应放热
【解析】
(1)图1所示实验中,用“分液漏斗”而不用“长颈漏斗”的原因是便于控制生成二氧化碳的速率;
(2)通过图象分析,最终溶液pH大于7,说明小苏打溶液是显碱性;
(3)加入过量的氯化钙溶液,产生白色沉淀,是因为碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠滴入酚酞试液,溶液变红色,是因为溶液中含有氢氧化钠,实验过程如下所示:
实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
① | 加入过量的氯化钙溶液; | 产生白色沉淀 | 含有碳酸钠、氢氧化钠 |
② | 滴入酚酞试液; | 溶液变红 |
(4)为确定 M 处溶液的成分,(3)中步骤①中加过量试剂的目的是使碳酸钠完全反应,避免对氢氧化钠检验产生干扰;步骤①②能颠倒,这是因为滴加酚酞试液后溶液变红色,再加入过量氯化钙溶液,如果产生白色沉淀,说明溶液中含有碳酸钠,如果溶液由红色变成无色,说明溶液中不含有氢氧化钠,如果溶液仍然是红色,说明溶液中含有氢氧化钠;
(5)实验过程中,同学们发现18min后溶液的pH不再变化,说明碳酸钠已经完全反应生成了碳酸氢钠,碳酸氢钠达到饱和状态时溶液pH不再变化,则此时烧杯中就可能观察到析出固体;
(6)图2中,BC段:碳酸钠和水、二氧化碳反应生成碳酸氢钠,发生反应的化学方程式为:Na2CO3+CO2+H2O=2NaHCO3;图3中,DE段温度变化的原因:氢氧化钠和二氧化碳反应放热。

【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
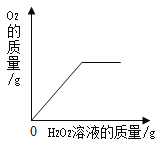
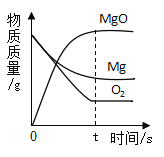
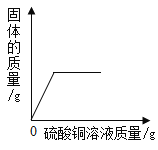
A.向一定质量的二氧化 锰中加入过氧化氢溶液 | B. 向等 质量的镁 粉和 铝粉中分别加入等浓度 的稀盐酸 | C. 镁在氧气中燃烧 | D. 向一定量铁粉和铜粉混 合物中加入硫酸铜溶液 |
A.AB.BC.CD.D
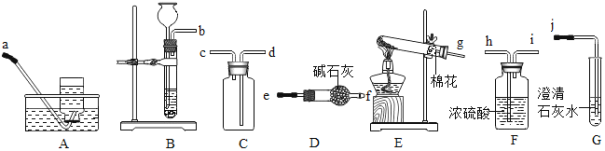
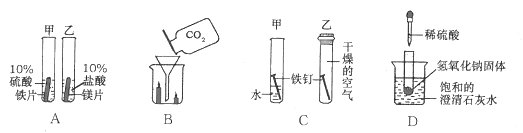
【题目】下列实验方案能达到实验目的的是
选项 | A | B | C | D |
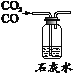
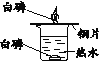
实验目的 | 证明CO2可与H2O反应生成H2CO3 | 除去CO2中的少量CO | 证明可燃物燃烧需要与O2接触 | 证明集气瓶中已充满CO2 |
实验方案 |
|
|
|
|
A. A B. B C. C D. D