题目内容
【题目】我国是世界化肥第一生产大国和消费大国。以空气和煤炭等为化工原料,可合成氨、尿素(CO(NH2)2),主要生产工艺流程如下图所示。回答下列问题:
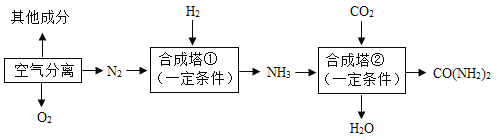
(1)工业合成氨的原料是氮气和氢气,氮气可从空气分离中获得。从液态空气中分离出N2的过程属于____(填“物理”或“化学”)变化。空气中含量少量的稀有气体,其化学性质极为_____(填“活泼”或“稳定”)。
(2)氢气通过煤和水蒸气在高温时反应得到的合成气(H2、CO)提取,制备合成气前需先将煤粉碎,这样做的目的是_____,反应的基本类型为________。
(3)写出合成塔①中合成氨的化学方程式为________。尿素属于_____(填“氮”“钾”“磷”或“复合”)肥。
(4)压强为101kPa下,氨气在不同温度下的溶解度如下表。氨水是氨气的水溶液,贮存时氨水要注意_____。
温度/℃ | 10 | 20 | 30 | 60 |
溶解度/g | 70 | 56 | 44.5 | 20 |
(5)2019年全国节能宣传周主题为“绿色发展,节能先行”。其中符合要求的___(填序号)
A 烟囱中排放出未经处理的烟尘、废水和废气
B 综合采用煤的洁净化技术
C 循环利用氮气、氢气和水
【答案】物理 稳定 增大接触面积,加快反应速率 置换反应 N2+3H2 2NH3 氮 阴凉密封 BC
2NH3 氮 阴凉密封 BC
【解析】
(1)工业合成氨的原料是氮气和氢气,氮气可从空气分离中获得。由于过程中没有新物质生成,所以此空气分离的变化属于物理变化;稀有气体的化学性质极为稳定。
(2)制备合成气前需先将煤粉碎,这样做的目的是增大接触面积,加快反应速率;煤和水蒸气在高温时反应得到的合成气(H2、CO)是一种单质与一种化合物作用,生成另一种单质与另一种化合物的反应,属于置换反应。
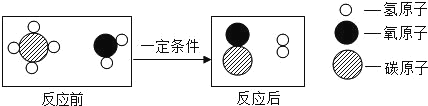
(3)合成塔①中是氮气和氢气在一定条件下生成氨,对应的化学方程式为N2+3H2 2NH3;尿素中含有氮元素,不含钾元素和磷元素,故属于氮肥。
2NH3;尿素中含有氮元素,不含钾元素和磷元素,故属于氮肥。
(4)温度越低,氨气溶解度越大,故氨水保存时要注意阴凉密封。
(5)A、烟囱中排放出未经处理的烟尘、废水和废气会导致污染环境,不符合环保要求,故A错误;
B、综合采用煤的洁净化技术,能够最大限度的减少污染,符合环保要求,故B正确;
C、循环利用氮气、氢气和水,能够节约能源,符合环保节能要求,故C正确。
故选BC。

【题目】某同学学习CO2的制取和性质时,设计了下列实验探究内容。按要求答题。
(1)不同实验对反应速率有不同要求。从所提供的限选选项中选择合适选项填写下表:
限选控制反应速率的方法:①反应物的浓度 ②反应物的状态 ③催化剂
限选试剂:A稀盐酸 B浓盐酸 C块状石灰石 D碳酸钠溶液 E粉末状石灰石 F二氧化锰G.H2O2溶液
实验名称 | 所选用的最佳试剂 | 控制速率的方法 |
过氧化氢制氧气(示例) | G和F | ③ |
CO2的实验室制法 | A和_______ | ________ |
(2)为探究SO2与CO2的性质异同,设计了如下实验:在水槽中注入一定体积的蒸馏水,并向其中滴加几滴试剂X,然后将分别集满SO2和CO2两种气体的试管同时倒立于水槽中,片刻后实验现象如右图所示,试管内溶液变成红色。请完成下面的实验报告:
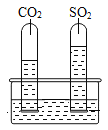
①SO2与CO2一样可溶于水,溶解性SO2_____CO2(填“>”或“<”或“=”)。
②SO2与CO2一样与水反应,均生成了有酸性的物质,X是______。
【题目】化学与生活密切相关。
Ⅰ.每100克巧克力中营养成分的含量如下表。
蛋白质/g | 脂肪/g | 糖类/g | 矿物质/mg | 维生素B/mg | 维生素C/mg | 总能量/千焦 | ||
5 | 32 | 51 | 钙 | 铁 | 磷 | 0.2 | _____ | 2142 |
50 | 4 | 120 | ||||||
(1)表中缺少人体必需的六大营养素中的____,2142千焦能量全部来自糖类吗?____(填“是”或“不是”)。
(2)摄入_____(填元素符号,下同)元素不足会导致骨骼疏松,易得佝偻病。钙、铁、磷元素中属于人体必需微量元素的是____。
Ⅱ.水是生命之源。请回答下列问题:
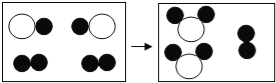
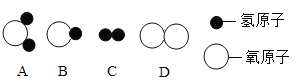
(1)构成水的粒子可表示为________(填序号)。
(2)下列物质加入水中能形成乳浊液的是________。(填序号)
A 粉笔灰 B 蔗糖 C 植物油
(3)硬水是指含有较多________、________(填微粒符号)的水。生活中,常用________鉴别硬水和软水。
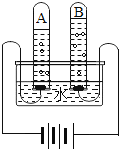
(4)如图为电解水的实验装置图,下列说法正确的是________。
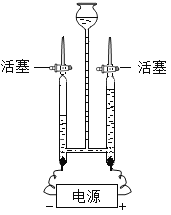
A 根据该实验所得产物,说明水分子可分
B 在水中加入少量稀硫酸以增强水的导电性
C 该实验中所得氢气和氧气的质量比约为2:1
D 与正极相连的玻璃管内得到的气体能使带火星的木条复燃